Процесс осмоса в биологии
Определение 1
Осмос – это давление жидкости внутри живой системы.
Сущность понятия осмос
Осмос имеет большое значение для жизнедеятельности представителей всех царств живой природы. Все биологические организмы состоят из клеток и внутри них в цитоплазме находится жидкость, которая содержит воду и различные вещества, растворенные в ней. Внутрь клетки вещества поступают строго избирательно, например, ионы, поддерживающие электронейтральность клеток.
Снаружи любая клетка омывается межклеточной жидкостью, которая тоже является водным раствором. Концентрация растворенных веществ внутри клеток гораздо больше, чем в межклеточной жидкости.
Осмос позволяет растворителю перейти из внешней среды в клетку и вызвать ее разбухание или тургор. Целесообразно привести определение данного понятия для формирования полного понимания заявленной темы.
Определение 2
Тургор – это давление воды на стенки клетки, придающее ей упругость и эластичность.
Кроме того, тургор способствует:
- сохранение формы клеток;
- стабилизация объема внутриклеточной жидкости;
- увлажнение растений.
Механизм протекания процесса
Благодаря осмотическому давлению становится возможным минеральное питание растений, поскольку именно оно обеспечивает восходящий ток воды от корня к листу и нисходящий ток жидкости для возвращения минеральных веществ в круговорот веществ. Осмотическое давление также поддерживается внутри ксилемы и флоэмы, которые являются разновидностями проводящей ткани растительного организма.
Также в организме человека присутствует ряд жидкостей, составляющих его внутреннюю среду: лимфу, кровь, тканевую жидкость. Они также обладают осмотическим давлением поддерживают его на постоянном уровне вне зависимости от температуры окружающей среды. Такое давление называют изоосмией и оно является составной частью общего процесса обмена веществ. Осмотическое давление крови различных организмов неодинаково.
Готовые работы на аналогичную тему
Если осмотическое давление крови снижается, то организм старается его воссоздать, удаляя из крови избыток растворенных частиц. Если же давление повышается, то число кинетически активных частиц значительно возрастает. Осмотическое давление крови поддерживается почками, но в этом процессе также участвует подкожно жировая клетчатка, которая накапливает избыток солей. Изоосмия регулируется, прежде всего, центральной нервной системой, а также деятельностью желез внутренней секреции.
Отклонение осмотического давления крови вызывает болезненное состояние. Симптомами его понижения являются:
- судороги,
- рвота,
- помутнение сознания.
Для предотвращения критического снижения величины осмотического давления в жидкостях организма необходимо соблюдать здоровый образ жизни и нормальный питательный и питьевой режим.
Растворы, которые имеют осмотическое давление, принятое за стандарт, называют изотоническими.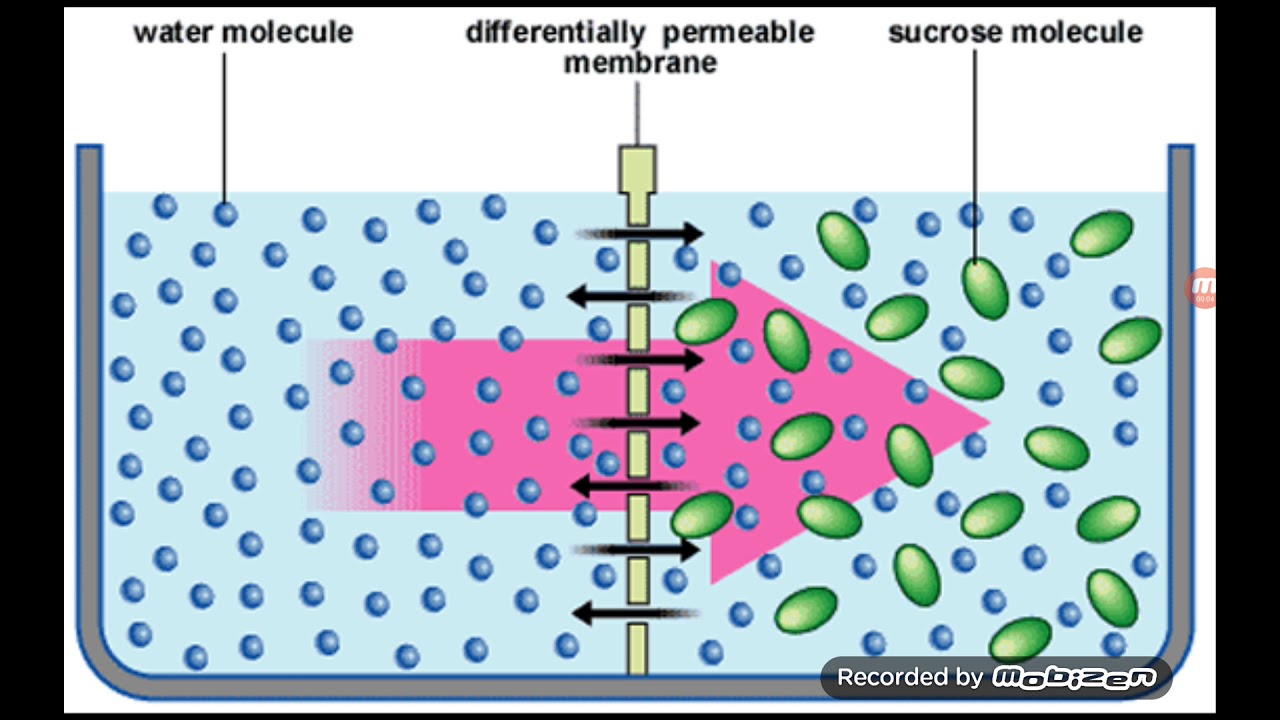 При превышении установленной величины раствор признают гипертоничесмким, сниженное осмотическое давление наделяет раствор гипотоническим свойством.
При превышении установленной величины раствор признают гипертоничесмким, сниженное осмотическое давление наделяет раствор гипотоническим свойством.
В медицине изотоническими по отношению к крови являются растворы с концентрацией солей 0,9%. Обратным процессом по отношению к осмосу можно признать плазмолизом. Он отражает потерю давления и упругости клетки. При сильном деплазмолизе клетка теряет собственную упругость и жизнеспособность. Для того, чтобы не допустить возникновения деплазмолиза внутри живой системы необходимо поддерживать нормальное осмотическое давление.
При нарушении осмоса может возникнуть гемолиз. Этот процесс является частным случаем цитолиза.
Определение 3
Цитолиз – это разрушение животных клеток под влиянием различных причин.
Например, в крови происходит разрушение всех оболочек, если осмотическое давление снижается до 260-300 кПа. Величина снижения осмотического давления, критическая для разных организмов может быть различной.
В клинической практике в некоторых случаях применяются изотонические и гипертонические растворы. Гипертонические растворы вводят внутривенно при глаукоме, чтобы снизить внутриглазное давление из – за повышенного содержания жидкости в передней глазной камере. Многие соли обладают слабительным действием, а именно глауберова (Na2SO4• 10h3O) и горькая (MgSO4• 7h3O) соли. Данные типы солей всасываются в кровь достаточно плохо, и их высокая концентрация в кишечнике способствует интенсивному переходу воды внутрь кишечника из тех тканей, которые окружают его.
Бактериальные клетки также обладают осмотическим давлением высокой величины. При действии антибиотиков (например, пенициллина) ингибируется процесс биосинтеза стенок растущих стрептококков. Они становятся непрочными и под действием внутреннего осмотического давления легко разрушаются. Таким образом, осмотическое давление способствует противостоянию бактериальным клеткам, поэтому формируют иммунитет.
Осмос является важным биологическим процессом и его значение заключается в следующем:
- осмос позволяет мембране контролировать процесс поступления различных веществ в собственное внутреннее пространство;
- обеспечивает потребление влаги и питательных веществ растениями, благодаря чему возможен фотосинтез;
- формирует тургорное давление, как возможность придания клетки упругости;
- выделение избытка солей из клетки, чтобы поддержать ее жизнеспособность;
- реализация деятельности вакуолей, а именно их сократительных форм.

Сначала набухают приводящие каналы, затем вода транслируется в их основной резервуар. В последствии он отделяется от приводящих каналов путем экзоцитоза. Две вакуоли работают в противофазе, каждая при нормальных физиологических условиях сокращается один раз в 12—15 с. За час вакуоли выбрасывают из клетки объём воды, примерно равный объёму клетки.
Тем самым понимание и контроль осмотических процессов формируют умение оказывать целенаправленное влияние на их протекание, что имеет крайне важное значение в медицине и биологии.
Об осмосе — простым языком
Расскажу простым и понятным языком, что такое осмос, и какая польза нам от использования этого принципа в быту и жизни.
Известно, что идеальной для человека является родниковая вода. Именно она — без запаха, прекрасно утоляет жажду и придает сил. Но почему? Почему родниковая вода так ценится?
На самом деле – все просто. Родник пробивается сквозь толщи, проходит множество слоёв. А это может быть глина, песок, чернозем, гипс, ракушечник. Благодаря подобной структуре почвы и отсеиваются примеси. Очищается она до кристальной чистоты. Вот поэтому родниковая вода – это синоним идеала.
Родник пробивается сквозь толщи, проходит множество слоёв. А это может быть глина, песок, чернозем, гипс, ракушечник. Благодаря подобной структуре почвы и отсеиваются примеси. Очищается она до кристальной чистоты. Вот поэтому родниковая вода – это синоним идеала.
Но почему мы так озабочены поисками этого самого идеала? Почему мы так радуемся, когда находим чистый родник? Почему так жадно пьем из него? Почему в 21 веке – веке технологий – мы так ценим природную чистоту?
Техническое развитие сделало воду общедоступной. Но…
Но несмотря на прогресс качество водопроводной воды ой, как далеко от идеала.
Что же так влияет на качество воды?
Во-первых, застой в трубах. Жир, пробки из песка, излишние изгибы – вот несколько причин застоя воды.
Во-вторых, химия в воде – это тот самый хлор, с помощью которого обеззараживают воду, а также вещества, используемые для умягчения воды.
Наш организм, получив эту воду, тратит силы на переработку и выведение этих «добавок».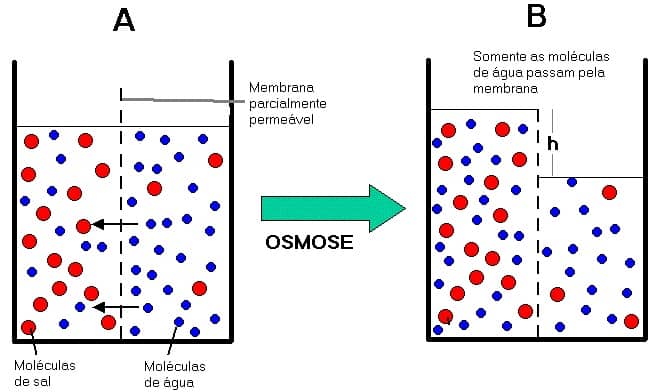 Но они настолько сильны, что полностью «химические приправы» не выходят, а навсегда остаются и накапливаются. К тому же нарушая функционал органов. Под ударом наши печень, почки и кишечник.
Но они настолько сильны, что полностью «химические приправы» не выходят, а навсегда остаются и накапливаются. К тому же нарушая функционал органов. Под ударом наши печень, почки и кишечник.
Так что – занавес? «Все пропало?»
Нет. Есть лучик света. Это слово из 5 букв – ОСМОС.
Вот что говорит Википедия: «О́смос (от греч. ὄσμος — толчок, давление) — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворенного вещества из объема с меньшей концентрацией растворенного вещества».
Этот принцип давно известен биологам — осмос играет важную роль в биологических процессах. Мембрана – основа осмоса — проницаема лишь для молекул воды, кислорода.
Как осмос борется с примесями в воде?
Наша родная вода в кране – это раствор, состоящий из множества молекул – кислорода, водорода и молекул примесей. В примесях — железо, ртуть, медь, нитраты, нефтепродукты, хлор, сероводород и т.д.
Вода под давлением попадает на мембрану. Создается осмотическое давление — молекулы воды проходят, более крупные молекулы примесей остаются на мембране.
Создается осмотическое давление — молекулы воды проходят, более крупные молекулы примесей остаются на мембране.
Все, все просто.
Вот поэтому вода, прошедшая через мембрану в осмотических системах, чиста от примесей.
Лайфхак: на мембранах указывают индексы 50G, 75G, 100G или 200G.
G — это галлоны, цифры обозначающие производительность мембраны в галлонах в сутки.
До новых встреч. Дмитрий РОМАНОВ
Действуйте! Выбирайте, консультируйтесь, подбирайте, сравнивайте, покупайте, радуйтесь!
Закажите установку в компании ФильтроМир! Круглосуточно отвечаем на ваши вопросы:
Осмос живой клетки | Русфильтр
Осмосом называют прохождение воды через избирательно проницаемую мембрану, в частности через клеточную мембрану. В случае клеточной мембраны осмос частично обусловлен диффузией отдельных молекул воды сквозь эту мембрану, а частично — током воды через особые поры в мембране.
Осмотическое движение воды зависит от двух главных факторов:
- от общей концентрации всех растворенных в воде частиц по обе стороны мембраны и
- от давления, создаваемого каждым раствором.
При прочих равных условиях вода стремится переходить через избирательно проницаемую мембрану от менее концентрированного раствора к раствору с более высокой общей концентрацией всех растворенных частиц (рис.1. ).
Рис. 1. Осмос в искусственной системе. Трубку, содержащую раствор глюкозы и закрытую с одного конца мембраной, пропускающей воду, но не пропускающей глюкозу, опускают закрытым концом в сосуд с водой. Вода может проходить через мембрану в том и в другом направлении; однако молекулы глюкозы в трубке мешают движению соседних молекул воды, и потому больше воды входит в трубку, чем выходит из нее.
Однако при этом в какой-то момент вода, поступившая в более концентрированный раствор, может развить такое давление, что это давление будет вытеснять ее наружу с такой же скоростью, с какой она поступает внутрь.
Не обладая способностью насасывать или откачивать воду непосредственно, клетки регулируют приток и отток воды, изменяя концентрацию находящихся в них растворенных веществ. Чтобы поглотить больше воды, клетка поглощает больше ионов различных солей, молекул глюкозы или других растворимых соединений. В результате в клетке повышается концентрация растворенных частиц. Вода по законам осмоса начинает поступать в клетку, стремясь к выравниванию своей собственной концентрации по обе стороны мембраны.
Так работает эта система до тех пор, пока концентрация растворенных веществ вне клетки и в клетке примерно одинакова.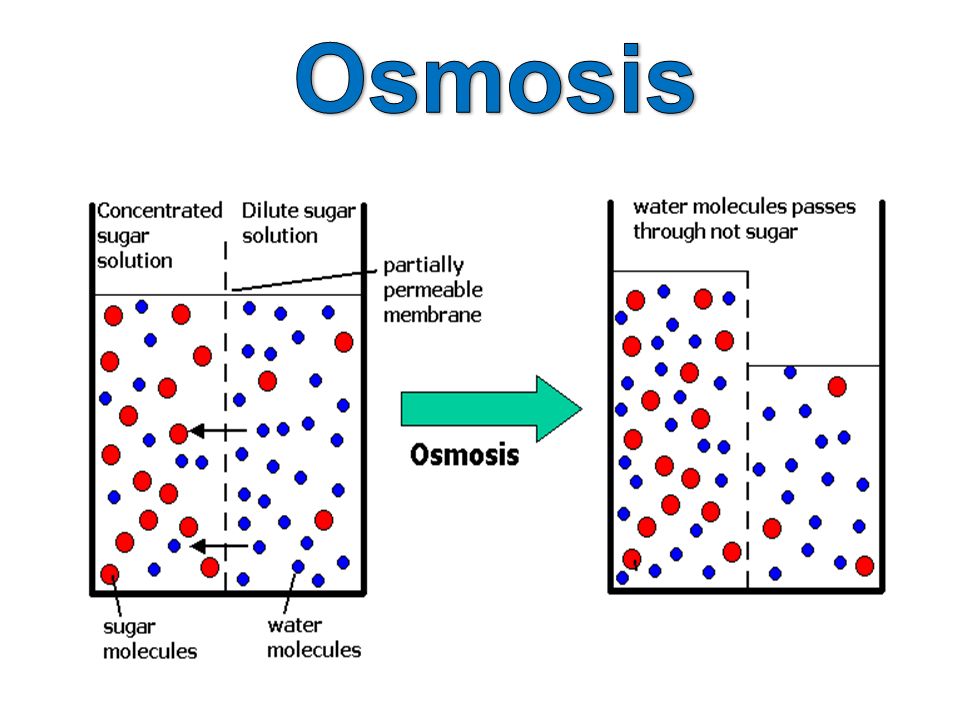 А что происходит, когда концентрация внутри и вне клетки очень сильно разнится? Если в среде концентрация растворенных веществ выше, чем в самой клетке, или если средой для клетки служит практически сухой воздух, то клетка теряет воду и сморщивается, как это бывает, когда растения привядают в сухой жаркий день. С оттоком воды содержимое клетки сжимается и отходит от клеточных стенок (рис. 2).
А что происходит, когда концентрация внутри и вне клетки очень сильно разнится? Если в среде концентрация растворенных веществ выше, чем в самой клетке, или если средой для клетки служит практически сухой воздух, то клетка теряет воду и сморщивается, как это бывает, когда растения привядают в сухой жаркий день. С оттоком воды содержимое клетки сжимается и отходит от клеточных стенок (рис. 2).
Рис. 2. Тургор и завядание у растений.
А. Растительные клетки, окруженные разбавленным раствором, поглощают воду путем осмоса через клеточную мембрану и остаются тургесцентными.
Б. Растительные клетки, окруженные концентрированным раствором, теряют воду вследствие осмоса, и растение завядает.
Если, однако, увядшее растение поместить в воду, то вода вновь поступает в клетки. Они становятся тургесцентными, т.е. набухают от воды и снова прижимаются к клеточным стенкам, подчиняясь тургорному давлению, направленному изнутри наружу.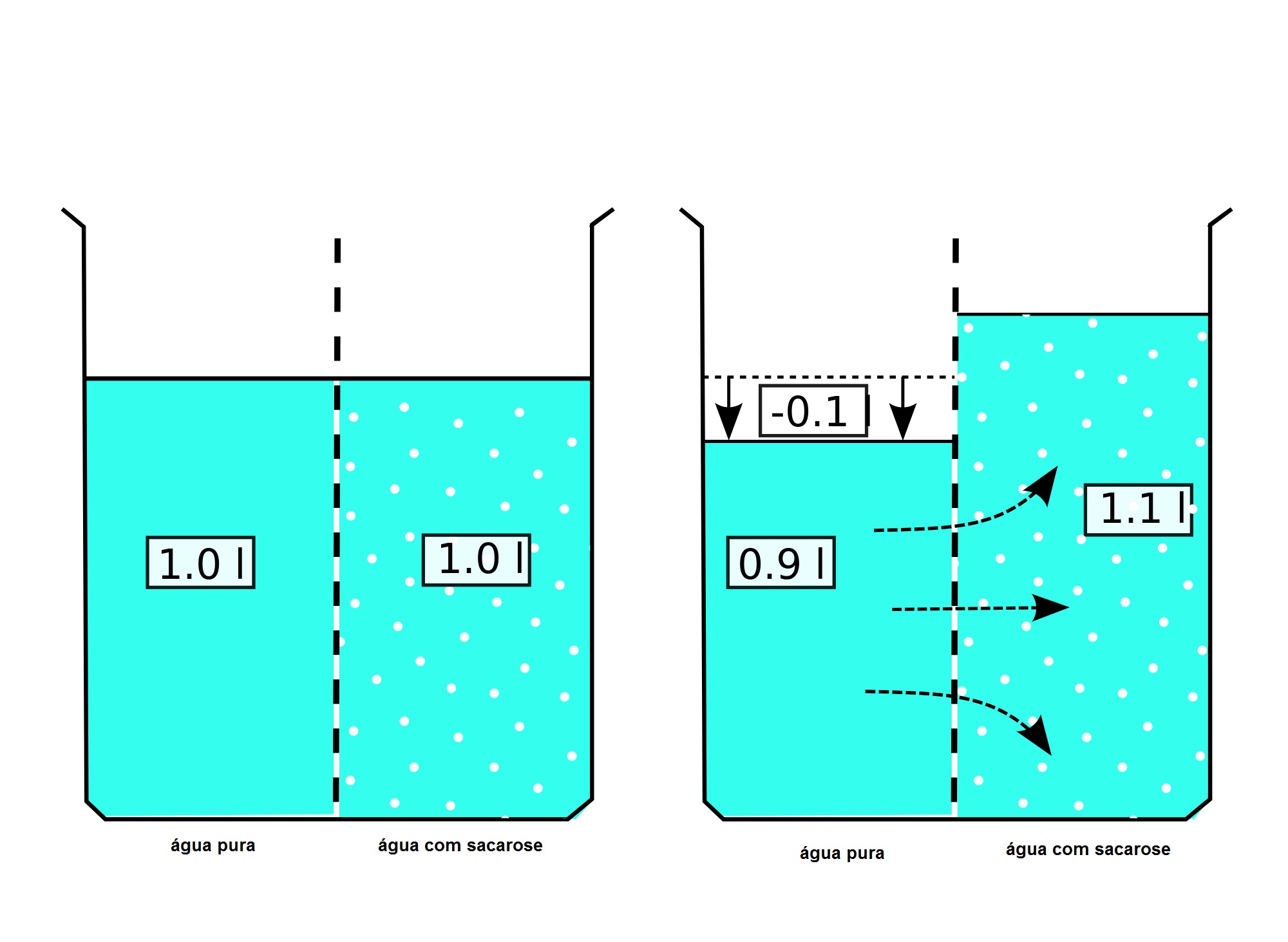 Клеточные стенки способны растягиваться лишь до известного предела, после которого они начинают оказывать противодавление, вытесняющее воду из клеток с такой же скоростью, с какой она в них поступает. Таким способом клеточные стенки защищают клетки: не дают им лопнуть под напором избытка воды.
Клеточные стенки способны растягиваться лишь до известного предела, после которого они начинают оказывать противодавление, вытесняющее воду из клеток с такой же скоростью, с какой она в них поступает. Таким способом клеточные стенки защищают клетки: не дают им лопнуть под напором избытка воды.
Многие животные клетки, если поместить их в чистую воду или в очень разбавленный раствор, лопаются, потому что у них нет клеточных стенок (рис. 3).
А. Животная клетка в разбавленном растворе поглощает воду до тех пор, пока не лопнет
Б. Животная клетка в концентрированном растворе теряет воду и сморщивается
Во избежание этого лекарственные препараты, предназначенные для внутривенного введения, готовят не на чистой воде, а на специальных солевых растворах. Животные клетки, соприкасающиеся с водой постоянно, например клетки, выстилающие желудочно-кишечный тракт человека, обладают приспособлениями, которые не дают им поглощать слишком много воды. Когда мы пьем воду, она всасывается и распределяется постепенно; именно поэтому клетки в нашем организме и не лопаются.
Когда мы пьем воду, она всасывается и распределяется постепенно; именно поэтому клетки в нашем организме и не лопаются.
Осмос — это… Что такое Осмос?
О́смос (от греч. ὄσμος — толчок, давление) — процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворённого вещества (меньшей концентрации растворителя).
Более широкое толкование явления осмоса основано на применении Принципа Ле Шателье — Брауна: если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Жан-Антуан НоллеИстория
Впервые осмос наблюдал А. Нолле в 1748, однако исследование этого явления было начато спустя столетие.
Суть процесса
Рис. 1. Осмос через полупроницаемую мембрану. Частицы растворителя (синие) способны пересекать мембрану, частицы растворённого вещества (красные) — нет.
Частицы растворителя (синие) способны пересекать мембрану, частицы растворённого вещества (красные) — нет.Явление осмоса наблюдается в тех средах, где подвижность растворителя больше подвижности растворённых веществ. Важным частным случаем осмоса является осмос через полупроницаемую мембрану. Полупроницаемыми называют мембраны, которые имеют достаточно высокую проницаемость не для всех, а лишь для некоторых веществ, в частности, для растворителя. (Подвижность растворённых веществ в мембране стремится к нулю). Как правило, это связано с размерами и подвижностью молекул, например, молекула воды меньше большинства молекул растворённых веществ. Если такая мембрана разделяет раствор и чистый растворитель, то концентрация растворителя в растворе оказывается менее высокой, поскольку там часть его молекул замещена на молекулы растворённого вещества (см. Рис. 1). Вследствие этого, переходы частиц растворителя из отдела, содержащего чистый растворитель, в раствор будут происходить чаще, чем в противоположном направлении. Соответственно, объём раствора будет увеличиваться (а концентрация вещества уменьшаться), тогда как объём растворителя будет соответственно уменьшаться.
Соответственно, объём раствора будет увеличиваться (а концентрация вещества уменьшаться), тогда как объём растворителя будет соответственно уменьшаться.
Например, к яичной скорлупе с внутренней стороны прилегает полупроницаемая мембрана: она пропускает молекулы воды и задерживает молекулы сахара. Если такой мембраной разделить растворы сахара с концентрацией 5 и 10 % соответственно, то через нее в обоих направлениях будут проходить только молекулы воды. В результате в более разбавленном растворе концентрация сахара повысится, а в более концентрированном, наоборот, понизится. Когда концентрация сахара в обоих растворах станет одинаковой, наступит равновесие. Растворы, достигшие равновесия, называются изотоническими. Если принять меры, чтобы концентрации не менялись, осмотическое давление достигнет постоянной величины, когда обратный поток молекул воды сравняется с прямым.
Осмос, направленный внутрь ограниченного объёма жидкости, называется эндосмосом, наружу — экзосмосом. Перенос растворителя через мембрану обусловлен осмотическим давлением. Это осмотическое давление возникает соответственно Принципу Ле Шателье из-за того, что система пытается выравнять концентрацию раствора в обоих средах, разделенных мембраной, и описывается вторым законом термодинамики. Оно равно избыточному внешнему давлению, которое следует приложить со стороны раствора, чтобы прекратить процесс, то есть создать условия осмотического равновесия. Превышение избыточного давления над осмотическим может привести к обращению осмоса — обратной диффузии растворителя.
Перенос растворителя через мембрану обусловлен осмотическим давлением. Это осмотическое давление возникает соответственно Принципу Ле Шателье из-за того, что система пытается выравнять концентрацию раствора в обоих средах, разделенных мембраной, и описывается вторым законом термодинамики. Оно равно избыточному внешнему давлению, которое следует приложить со стороны раствора, чтобы прекратить процесс, то есть создать условия осмотического равновесия. Превышение избыточного давления над осмотическим может привести к обращению осмоса — обратной диффузии растворителя.
В случаях, когда мембрана проницаема не только для растворителя, но и для некоторых растворённых веществ, перенос последних из раствора в растворитель позволяет осуществить диализ, применяемый как способ очистки полимеров и коллоидных систем от низкомолекулярных примесей, например электролитов.
Значение осмоса
Осмос играет важную роль во многих биологических процессах. Мембрана, окружающая нормальную клетку крови, проницаема лишь для молекул воды, кислорода, некоторых из растворённых в крови питательных веществ и продуктов клеточной жизнедеятельности; для больших белковых молекул, находящихся в растворённом состоянии внутри клетки, она непроницаема. Поэтому белки, столь важные для биологических процессов, остаются внутри клетки.
Поэтому белки, столь важные для биологических процессов, остаются внутри клетки.
Осмос участвует в переносе питательных веществ в стволах высоких деревьев, где капиллярный перенос не способен выполнить эту функцию.
Осмос широко используют в лабораторной технике: при определении молярных характеристик полимеров, концентрировании растворов, исследовании разнообразных биологических структур. Осмотические явления иногда используются в промышленности, например при получении некоторых полимерных материалов, очистке высоко-минерализованной воды методом обратного осмоса жидкостей.
Клетки растений используют осмос также для увеличения объёма вакуоли, чтобы она распирала стенки клетки (тургорное давление). Клетки растений делают это путём запасания сахарозы. Увеличивая или уменьшая концентрацию сахарозы в цитоплазме, клетки могут регулировать осмос. За счёт этого повышается упругость растения в целом. С изменениями тургорного давления связаны многие движения растений (например, движения усов гороха и других лазающих растений). Пресноводные простейшие также имеют вакуоль, но задача вакуолей простейших заключается лишь в откачивании лишней воды из цитоплазмы для поддержания постоянной концентрации растворённых в ней веществ.
Пресноводные простейшие также имеют вакуоль, но задача вакуолей простейших заключается лишь в откачивании лишней воды из цитоплазмы для поддержания постоянной концентрации растворённых в ней веществ.
Осмос также играет большую роль в экологии водоёмов. Если концентрация соли и других веществ в воде поднимется или упадёт, то обитатели этих вод погибнут из-за пагубного воздействия осмоса.
Использование в промышленности
Первая в мире электростанция — прототип, использующая для выработки электричества явление осмоса, запущена компанией Statkraft 24 ноября 2009 года в Норвегии вблизи города Тофте. Солёная морская и пресная вода на электростанции разделены мембраной; так как концентрация солей в морской воде выше, между солёной водой моря и пресной водой фьорда развивается явление осмоса, — постоянный поток молекул воды через мембрану в сторону солёной воды. В результате чего давление солёной воды возрастает.[1] Это давление соответствует давлению столба воды в 120 метров высотой, то есть достаточно высокому водопаду. Поток воды достаточен, чтобы приводить в действие гидротурбину, вырабатывающую энергию.[2] Производство носит ограниченный характер, основная цель — тестирование оборудования. Самый проблематичный компонент электростанции — мембраны. По оценкам специалистов Statkraft мировое производство может составить от 1 600 до 1 700 TWh, что сравнимо с потреблением Китая в 2002. Ограничение связано с принципом действия — подобные электростанции могут быть построены только на морском побережье.[3] Это не вечный двигатель, источником энергии является энергия солнца. Солнечное тепло отделяет воду от моря при испарении и посредством ветра переносит на сушу. Потенциальная энергия используется на гидроэлектростанциях, а химическая энергия долго оставалась без внимания.
Поток воды достаточен, чтобы приводить в действие гидротурбину, вырабатывающую энергию.[2] Производство носит ограниченный характер, основная цель — тестирование оборудования. Самый проблематичный компонент электростанции — мембраны. По оценкам специалистов Statkraft мировое производство может составить от 1 600 до 1 700 TWh, что сравнимо с потреблением Китая в 2002. Ограничение связано с принципом действия — подобные электростанции могут быть построены только на морском побережье.[3] Это не вечный двигатель, источником энергии является энергия солнца. Солнечное тепло отделяет воду от моря при испарении и посредством ветра переносит на сушу. Потенциальная энергия используется на гидроэлектростанциях, а химическая энергия долго оставалась без внимания.
Примечания
Ссылки
Краткий обзор процесса и применения обратного осмоса
Обратный осмос (RO) представляет собой технологическую технологию на основе мембран для очистки воды путем отделения растворенных твердых веществ от потока сырья, что приводит к потоку пермеата и отбраковке для широкого спектра применений как в быту, так и в промышленности. Из обзора литературы видно, что технология RO используется для удаления растворенных твердых веществ, цвета, органических загрязнителей и нитрата из исходного потока. Следовательно, технология RO используется для обработки воды и опасных отходов, процессов разделения в пищевой, пищевой и бумажной промышленности, а также для восстановления органических и неорганических материалов из химических процессов в качестве альтернативного метода. Настоящий документ предусматривает общее видение технологии RO как альтернативного метода обработки сточных вод в различных промышленных приложениях. В настоящем кратком обзоре показана применимость системы RO для обработки сточных вод из индустрии напитков, отработанной промывки, обработки грунтовых вод, извлечения фенольных соединений и рекультивации обработки обратного осмоса сточных вод и морской воды (SWRO), указывающих эффективность и применимость технологии RO.
Из обзора литературы видно, что технология RO используется для удаления растворенных твердых веществ, цвета, органических загрязнителей и нитрата из исходного потока. Следовательно, технология RO используется для обработки воды и опасных отходов, процессов разделения в пищевой, пищевой и бумажной промышленности, а также для восстановления органических и неорганических материалов из химических процессов в качестве альтернативного метода. Настоящий документ предусматривает общее видение технологии RO как альтернативного метода обработки сточных вод в различных промышленных приложениях. В настоящем кратком обзоре показана применимость системы RO для обработки сточных вод из индустрии напитков, отработанной промывки, обработки грунтовых вод, извлечения фенольных соединений и рекультивации обработки обратного осмоса сточных вод и морской воды (SWRO), указывающих эффективность и применимость технологии RO.
Вступление
Обратный осмос (RO) представляет собой процесс, который использует полупроницаемые спирально-навитые мембраны для отделения и удаления из воды растворенных твердых веществ, органических, пирогенов, субмикронного коллоидного вещества, цвета, нитрата и бактерий. Подаваемая вода подается под давлением через полупроницаемую мембрану, где вода пропитывает мельчайшие поры мембраны и поставляется в виде очищенной воды, называемой пермеатной водой. Примеси в воде концентрируются в отбракованном потоке и промываются в слив, называются отброшенной водой. Эти мембраны являются полупроницаемыми и отбрасывают соли, одновременно пропуская молекулы воды. Материалы, используемые для мембран RO, изготовлены из ацетата целлюлозы, полиамидов и других полимеров. Мембрана состоит из половолоконного, спирально-раневого, используемого для лечения; зависят от состава питательной воды и рабочих параметров установки. Обратный осмос (RO) — это технологическая технология на основе мембран, используемая для опреснения. Мембранное опреснение морской воды и повторное использование сточных вод широко рассматриваются в качестве перспективных решений по увеличению водоснабжения и уменьшению дефицита воды (S. Lee et al., 2010). Наиболее распространенными мембранными процессами являются обратный осмос (RO) и электродиализ (ED), используемый для опреснения солоноватой воды, но только RO конкурирует с процессами дистилляции при опреснении морской воды (Kalogirou, 2005).
Подаваемая вода подается под давлением через полупроницаемую мембрану, где вода пропитывает мельчайшие поры мембраны и поставляется в виде очищенной воды, называемой пермеатной водой. Примеси в воде концентрируются в отбракованном потоке и промываются в слив, называются отброшенной водой. Эти мембраны являются полупроницаемыми и отбрасывают соли, одновременно пропуская молекулы воды. Материалы, используемые для мембран RO, изготовлены из ацетата целлюлозы, полиамидов и других полимеров. Мембрана состоит из половолоконного, спирально-раневого, используемого для лечения; зависят от состава питательной воды и рабочих параметров установки. Обратный осмос (RO) — это технологическая технология на основе мембран, используемая для опреснения. Мембранное опреснение морской воды и повторное использование сточных вод широко рассматриваются в качестве перспективных решений по увеличению водоснабжения и уменьшению дефицита воды (S. Lee et al., 2010). Наиболее распространенными мембранными процессами являются обратный осмос (RO) и электродиализ (ED), используемый для опреснения солоноватой воды, но только RO конкурирует с процессами дистилляции при опреснении морской воды (Kalogirou, 2005).
1.1 Объем обратного осмоса
Этот процесс также применяется для очистки городских сточных вод. Поскольку обычные методы муниципальной обработки не удаляют растворенные твердые вещества, но процесс RO используется для удаления растворенных твердых веществ. RO все чаще используется в качестве метода разделения в химической и экологической технике для удаления органических веществ и органических загрязнителей, присутствующих в сточных водах. Из обзора литературы видно, что процессы обратного осмоса (РО) широко используются для разделения и концентрации (восстановления) растворенных веществ во многих областях.
Использование RO при обработке различных стоков химического вещества (Bodalo-Santoyo et al., 2004; BodaloSantoyo et al., 2003), нефтехимической, электрохимической, пищевой, бумажной и кожевенной промышленности, а также в обработке городских сточных вод были зарегистрированы в литературе и изучены многими исследователями (Schutte et al., 2003). Удаление органических загрязнителей методами RO впервые было продемонстрировано Chian et al. (1975). Наличие отдельных загрязнителей может вызвать проблемы, поэтому удаление отдельных загрязняющих веществ с помощью RO изучено очень немногими исследователями (Murthy et al., 1999; Moresi et al., 2002; Arsuaga et al., 2006). Murthy и Choudhari (2008) изучили статью «Лечение отгонной промывки ликеро-водочным раствором, где мембраны UF и RO, используемые для очистки сточных вод, удаляют цвет и загрязняющие вещества». Ряд исследований (Kimura et al., 2003; Bellona et al., 2004; Xu et al., 2005) сообщалось о применении RO для удаления органических веществ, таких как эндокринные разрушающие химические вещества, пластические добавки, пестициды, фармацевтически активные соединения (PhaC), бензол и толуол. Ацетат целлюлозы и полиамидная мембрана имеют хорошее отверждение солей для неорганических солей, таких как NaCl, Na2SO4. Однако для органических веществ отклонение, как сообщается, является более низким и широко варьируется в диапазоне 0,3-0,96 (Pozderivic et al.
(1975). Наличие отдельных загрязнителей может вызвать проблемы, поэтому удаление отдельных загрязняющих веществ с помощью RO изучено очень немногими исследователями (Murthy et al., 1999; Moresi et al., 2002; Arsuaga et al., 2006). Murthy и Choudhari (2008) изучили статью «Лечение отгонной промывки ликеро-водочным раствором, где мембраны UF и RO, используемые для очистки сточных вод, удаляют цвет и загрязняющие вещества». Ряд исследований (Kimura et al., 2003; Bellona et al., 2004; Xu et al., 2005) сообщалось о применении RO для удаления органических веществ, таких как эндокринные разрушающие химические вещества, пластические добавки, пестициды, фармацевтически активные соединения (PhaC), бензол и толуол. Ацетат целлюлозы и полиамидная мембрана имеют хорошее отверждение солей для неорганических солей, таких как NaCl, Na2SO4. Однако для органических веществ отклонение, как сообщается, является более низким и широко варьируется в диапазоне 0,3-0,96 (Pozderivic et al. , 2006; Senthilmurugan and Gupta, (2006). Процесс RO удаляет пропорционально, если TDS находится на допустимом уровне и содержание фторида является высоким, тогда можно использовать специальный фильтр из квасцово-полимерной смолы, работающий под действием силы тяжести (Krishnan S. et al., 2005).
, 2006; Senthilmurugan and Gupta, (2006). Процесс RO удаляет пропорционально, если TDS находится на допустимом уровне и содержание фторида является высоким, тогда можно использовать специальный фильтр из квасцово-полимерной смолы, работающий под действием силы тяжести (Krishnan S. et al., 2005).
1.2 Варианты лечения обратного осмоса
В Индии ликеро-водочный завод использует различные формы первичной, вторичной и третичной обработки сточных вод. Используемые процессы единиц — это скрининг и выравнивание, за которыми следует биометанизация. Наиболее распространенными вариантами удаления сточных вод (Ramana et al., 2002) являются фертиобразование и биокомпостирование с помощью прессования сахарным тростником. В случае ликероводочного завода на основе зерен обработка проводится путем разделения, сжигания и биомеханизации DWGS. Технологические потоки, которые могут быть переработаны, — это тонкий шлак и технологический конденсат. Поток, образующийся после удаления твердых веществ. Тонкий отстойник содержит высокие TDS, высокую температуру и содержит углеводы, органические кислоты, мертвые дрожжевые клетки и т.д., Которые могут влиять на процесс ферментации. Технологический конденсат из испарителя имеет высокую температуру, низкий уровень pH, органические кислоты и т.д. Это можно обработать системой RO и использовать в процессе или для использования в коммунальных службах.
Тонкий отстойник содержит высокие TDS, высокую температуру и содержит углеводы, органические кислоты, мертвые дрожжевые клетки и т.д., Которые могут влиять на процесс ферментации. Технологический конденсат из испарителя имеет высокую температуру, низкий уровень pH, органические кислоты и т.д. Это можно обработать системой RO и использовать в процессе или для использования в коммунальных службах.
1.3 Обратный процесс осмоса. Описание
Процесс RO прост в дизайне, состоящем из потока подачи, пермеата и отбраковки. Для питательной воды необходимо обеспечить предварительную обработку, чтобы удалить неорганические твердые вещества и взвешенное твердое вещество и с помощью насоса высокого давления, подаваемого через полупроницаемую мембрану. В зависимости от пермеата, где он используется, необходимо назначить последующее лечение. Принципиальная схема процесса RO показана на рисунке 1.
Рисунок 1. Схематическая схема процесса RO
1.4 Обратный осмос.
 Реквизиты
Реквизиты Установка обессоливания RO по существу состоит из четырех основных систем: (a) системы предварительной обработки, (b) насосов высокого давления, (c) мембранных систем и (d) последующей обработки. Предусмотрена система предварительной обработки для удаления всех взвешенных твердых частиц, чтобы на мембранах не возникало осаждение соли или рост микроорганизмов. Предварительная обработка может включать в себя традиционные методы, такие как химический корм с последующей коагуляцией/флокуляцией/осаждением, фильтрацией песка или мембранными процессами, т.е. микрофильтрацией (МФ) и ультрафильтрацией (UF). Насосы высокого давления обеспечивают давление, необходимое для пропускания воды через мембрану и отклонения соли. Давление колеблется от 17 до 27 бар для солоноватой воды и от 52 до 69 бар для морской воды. Мембранные системы состоят из сосуда высокого давления и полупроницаемой мембраны внутри, что позволяет пропускать через нее питательную воду. RO мембраны для опреснения обычно бывают двух типов: спиральная и полые волокна. В зависимости от качества воды пермеата и использования пермеата; пост-лечение может состоять в корректировке рН и дезинфекции (Djebedjian et al, 2006).
В зависимости от качества воды пермеата и использования пермеата; пост-лечение может состоять в корректировке рН и дезинфекции (Djebedjian et al, 2006).
1.5 Мембранные характеристики
Мембрана должна быть недорогой, иметь более длительный и стабильный срок службы. Мембрану следует легко изготовить с хорошим отслаиванием соли, то есть слегка проницаемым для соли. Они должны иметь высокий поток воды, который очень проницаем для воды и менее подвержен загрязнению. Они должны допускать поток больших количеств воды через мембрану относительно объема, который они занимают. Мембрана должна быть химически, физически и термически устойчивой в соленой воде. Они должны быть достаточно прочными, чтобы выдерживать высокие давления и качество подаваемой воды.
1.6 Преимущества процесса RO
Ниже приведены преимущества процесса RO, которые делают его привлекательным для разбавленных водных сточных вод, включают:
(1) системы RO просты в проектировании и эксплуатации, имеют низкие требования к обслуживанию и носят модульный характер, что упрощает расширение систем;
(2) Как неорганические, так и органические загрязнители могут быть удалены одновременно с помощью мембранных процессов RO;
(3) системы RO позволяют извлекать / рециркулировать потоки отходов, не влияя на извлеченный материал;
(4) системы RO требуют меньше энергии по сравнению с другими технологиями; а также
(5) Процессы RO могут значительно уменьшить объем потоков отходов, с тем чтобы их можно было обрабатывать более эффективно и экономично с помощью других процессов, таких как сжигание (Cartwright, 1985; Sinisgalli and McNutt, 1986; Cartwright, 1990; McCray et al. , 1990; Cartwright, 1991; Williams et al. ., 1992).
, 1990; Cartwright, 1991; Williams et al. ., 1992).
(6) Установка RO обычно эксплуатируется при температуре окружающей среды, что снижает проблемы образования накипи и коррозии из-за использования антираспадных и биодисперсных материалов, что снижает затраты на техническое обслуживание.
(7) Модульная структура процесса RO повышает гибкость в строительстве опреснительных установок в широком диапазоне мощностей.
(8) Удельная потребность в энергии значительно ниже 39,4 кВт ч/м3 продукта.
(9) Процесс электрически управляется, поэтому он легко адаптируется к питанию солнечными батареями.
Кроме того, системы RO могут заменяться или использоваться в сочетании с другими процессами обработки, такими как окисление, адсорбция, десорбция или биологическая обработка (как и многие другие) для получения высококачественной воды для продуктов, которую можно повторно использовать или выгружать.
2.1 Применение обратного осмоса
Эта технология имеет преимущество мембранного процесса, в котором концентрация и разделение достигаются без изменения состояния и без использования химических веществ или тепловой энергии, что делает процесс энергоэффективным и идеально подходит для приложений восстановления. В библиографическом обзоре показана применимость системы RO для обработки сточных вод из индустрии напитков, отработанной промывки, обработки грунтовых вод, извлечения фенольных соединений и рекультивации обработки обратного осмоса сточных вод и морской воды, что указывает на эффективность и применимость технологии RO.
В библиографическом обзоре показана применимость системы RO для обработки сточных вод из индустрии напитков, отработанной промывки, обработки грунтовых вод, извлечения фенольных соединений и рекультивации обработки обратного осмоса сточных вод и морской воды, что указывает на эффективность и применимость технологии RO.
2.2. Перегоняемая промывка
Проводимая промывка в ликероводочной промышленности кислотная, имеющая pH 3,94-4.30, темно-коричневая жидкость с высоким БПК 45000-1000000 мг/л. и ХПК 90000 — 210000 мг/л. и испускает неприятный запах, но не содержит токсичных веществ, когда выгрузка в потоках воды дает немедленное обесцвечивание и истощение растворенного кислорода, серьезную угрозу водной флоре и фауне (Mane et al., 2006). Для обработки сточных вод ликероводочного завода применялись мембранные процессы разделения, такие как ультрафильтрация (UF), нанофильтрация (NF), обратный осмос (RO) и мембранный биореактор (MBR) (Nataraj et al., 2006; Couallier et al., 2006; Zhang et al. , Murthy And Chaudhari, 2006). Murthy и Choudhari (2008) изучили статью «Лечение отгонной промывки ликеро-водочным раствором, где мембраны UF и RO на опытной установке используют тонкопленочную композитную мембрану для очистки сточных вод для удаления цвета и загрязнений. Полученный результат указывает на пригодность RO для сокращения потребления пресной воды за счет рециркуляции воды, что минимизирует затраты на удаление отходов и снижение регулирующего давления. Пилотная установка дает удаление полностью растворенных твердых веществ (TDS), химического спроса на кислород (ХПК), биохимического спроса на кислород (БПК), сульфата и калия с эффективностью отбраковки 97,9%, 96,8%, 97,9%, 99,7% и 94,65% соответственно. Вышеуказанные результаты были получены для потока подачи 15 л./мин. и давления подачи 20 атм. Они обнаружили, что TDS в пропитанной воде составляет менее 1000 ppm и COD 500 ppm, т.е. в пределах, установленных в соответствии с руководящими принципами Всемирной организации здравоохранения (ВОЗ) и Центрального комитета по контролю загрязнения (CPCB) Индии.
, Murthy And Chaudhari, 2006). Murthy и Choudhari (2008) изучили статью «Лечение отгонной промывки ликеро-водочным раствором, где мембраны UF и RO на опытной установке используют тонкопленочную композитную мембрану для очистки сточных вод для удаления цвета и загрязнений. Полученный результат указывает на пригодность RO для сокращения потребления пресной воды за счет рециркуляции воды, что минимизирует затраты на удаление отходов и снижение регулирующего давления. Пилотная установка дает удаление полностью растворенных твердых веществ (TDS), химического спроса на кислород (ХПК), биохимического спроса на кислород (БПК), сульфата и калия с эффективностью отбраковки 97,9%, 96,8%, 97,9%, 99,7% и 94,65% соответственно. Вышеуказанные результаты были получены для потока подачи 15 л./мин. и давления подачи 20 атм. Они обнаружили, что TDS в пропитанной воде составляет менее 1000 ppm и COD 500 ppm, т.е. в пределах, установленных в соответствии с руководящими принципами Всемирной организации здравоохранения (ВОЗ) и Центрального комитета по контролю загрязнения (CPCB) Индии.
2.3 Обработка грунтовых вод
Belkacem et al. (2006), изучил обработку грунтовых вод, в которой использовался двухступенчатый модуль RO в индустрии напитков. Результаты физико-химического анализа показали, что сырая вода, взятая из подземных вод, содержала значительные количества растворенных веществ и взвешенных твердых веществ (TDS в диапазоне от 757 мг/л. до 964 мг/л.). Состав питательной воды показывает, что сырая вода была богата сульфатом, хлоридом и кальцием и сильно вымывается. Качество воды, полученное в результате предварительной обработки, демонстрирует, что мутность претерпела самые сильные сокращения на 87%, т.е. уменьшилась с 1,3 НТУ до 0,167 НТУ. Скорость отбраковки варьировала от 97% до 98% и оставалась стабильной во время операции РО, что означало, что качество пермеата было постоянным с общей проводимостью, уменьшилось с 1070 мкс/см до 33 мкс/см при более крупном отбраковывании ионов 95%. Эффективность удаления бактерий микроорганизмов снижалась от 90 UFC/100 мл. до 50 UFC/100 мл., что представляет собой полное устранение 44%. Однако отказ от нитрата был самым низким, т.е. около 88,18%. Следовательно, полученные результаты показали применимость RO для обработки грунтовых вод.
до 50 UFC/100 мл., что представляет собой полное устранение 44%. Однако отказ от нитрата был самым низким, т.е. около 88,18%. Следовательно, полученные результаты показали применимость RO для обработки грунтовых вод.
2.4. Восстановление фенольных соединений
Kurihara et al. (1981) использует композитную мембрану Toray PEC-1000 (полифуран) и обнаружил несколько органических отторжек с 97% для ацетона и 99% для фенола. Koyama et al. (1982) и Koyama et al. (1984) сообщают результаты разделения для нескольких полярных органических растворов (спиртов, фенолов, карбоновых кислот, аминов и кетонов) и различных фенольных производных для составной мембраны. Они обнаружили, что основными факторами, влияющими на отторжение, являются молекулярная масса, молекулярное разветвление, полярность и степень диссоциации для ионизируемых соединений.
Bhattacharyya et al. (1987) и Bhattacharyya and Madadi (1988) исследовали характеристики отторжения и флюса мембран FT30 для разделения различных загрязняющих веществ (ПАУ, хлорофенолы, нитрофенолы) и обнаруженные мембранные отторжения были более чем (> 98%) для органических веществ в ионизованных условиях. Они также обнаружили существенное снижение потока воды даже для разбавленных (<50 мг/л.) растворов неионизированных органических веществ и в некоторых случаях наблюдали значительную органическую адсорбцию на мембране. Pusch et al. (1989) сообщают результаты разделения для нескольких различных мембран (четырех композитных и двух асимметричных) для различных одно- и многокомпонентных органических растворов, включая многие органические загрязнители. Отклонения варьировались от 25% до > 99% в зависимости от растворенного вещества, но, как правило, отбраковка композитных мембран была выше.
Они также обнаружили существенное снижение потока воды даже для разбавленных (<50 мг/л.) растворов неионизированных органических веществ и в некоторых случаях наблюдали значительную органическую адсорбцию на мембране. Pusch et al. (1989) сообщают результаты разделения для нескольких различных мембран (четырех композитных и двух асимметричных) для различных одно- и многокомпонентных органических растворов, включая многие органические загрязнители. Отклонения варьировались от 25% до > 99% в зависимости от растворенного вещества, но, как правило, отбраковка композитных мембран была выше.
Srinivasan et al. (2010), были проведены эксперименты по извлечению фенольных соединений в лабораторном масштабе на основе спирального полиамида и его модуля. В их исследовании использовалась полиамидная мембрана Perma-TFC в конфигурации спиральной намотки (поставляемая Permionics, Вадодара, Индия). Было обнаружено, что значение отклонения возрастает с увеличением приложенного давления. Максимальное количество отбраковки составляет около 90% для фенола.
2.5 Рекультивация сточных вод
Сточные воды содержат органические загрязнители, включая фармацевтические соединения, патогены, дезинфекционные побочные продукты и пестициды. Они менее подвержены влиянию биологической деградации бактериями в процессе активного ила. Из-за их водорастворимости они растворяются в воде и не удаляются в осадке, что создаст проблему для безопасности рекуперированной воды. Таким образом, использование процесса RO для разделения является ключевым шагом в безопасном извлечении воды из источника сточных вод. Недавнее использование RO в мелиорации сточных вод осуществляется в установке GWR в Orange County для косвенного использования в питьевой воде. Он используется для производства 280 000 м3/сут очищенных сточных вод, которые используются для увеличения подземных вод в регионе, который снабжает местные муниципалитеты питьевой водой. (Franks 2004). РО играет неотъемлемую роль в усовершенствованном процессе обработки, используемом на этом заводе. На этом растении мембраны с низким давлением, высоким уровнем отбраковки ESPA2 используются для получения проницаемости RO с менее чем 50 мг/л. TDS, что сделает воду с регенерированной водой безопасным для потенциального повторного использования в питьевой воде.
На этом растении мембраны с низким давлением, высоким уровнем отбраковки ESPA2 используются для получения проницаемости RO с менее чем 50 мг/л. TDS, что сделает воду с регенерированной водой безопасным для потенциального повторного использования в питьевой воде.
2.6 Морской реверс
В блоке SWRO (Sea water Reverse osmosis), условиях эксплуатации и производительности блока HFF SWRO, который получил продукт NF в качестве корма. Узел SWRO состоит из двух узлов судна, которые соединены последовательно. В течение испытательного периода рабочее давление поддерживалось на уровне 60 кг/см2, а температура колебалась от 23 до 34oC. Средний уровень проницаемости для первого и второго судов составил около 30 и 21 процента соответственно, а общее восстановление интегрированной системы SWRO составляло около 45%. Химический анализ показал, что большинство ионов твердости и других растворенных солей концентрировали в рассоле рассола. Исследование показало, что увеличение верхней температуры рассола от 1000 до 130oC приводит к увеличению производства воды на 48%. (Хамед, 2005).
(Хамед, 2005).
3.0 Заключение
Подача Вода, содержащая взвешенные частицы, органическое вещество, а также неорганическая соль может осаждаться на мембране, а загрязнение происходит или повреждает мембрану из-за приложенного давления и размера частиц. Поэтому приоритет для их удаления путем предварительной обработки будет определять эффективность RO. Следовательно, характеристики мембраны RO можно проверить, чтобы избежать необратимых повреждений мембраны RO. Фактически успех системы RO зависит от эффективности предварительной обработки. Последующая обработка рассольных потоков представляет собой серьезную проблему с растущей опреснительной способностью для минимизации ущерба окружающей среде, который зависит от местоположения растения.
4.0 Сфера будущего
Использование предварительно нагретой питательной воды, работа при низком давлении, предварительная предварительная обработка исходной воды, усовершенствованные системы рекуперации энергии, оптимизация сайта и автоматические системы управления заводом в реальном времени — это возможная область, где необходимы исследования и разработки с разработкой мембранного материала для поддержания максимальная температура, которая повысит производительность растения, тем самым снижая стоимость лечения.
Использованные источники
1) Arsuaga, J.M., M.J. Lopez Munoz, A. Sotto and G. del Rosario, (2006),” Retention of phenols and carboxylic acids by nanofiltration/reverse osmosis membranes: Sieving and membrane solute interaction effects“, Desalination, 731- 733.
2) Bellona, C., J.E. Drewes, P. Xua and G. Amy,(2004):,”Factors affecting the rejection of organic solutes during NF/RO treatment-a literature review“, Water Res., 38: 2795-2809.
3) Bhattacharyya, D., and Madadi, M.R., (1988): «Separation of Phenolic Compounds by Low Pressure Composite Membranes: Mathematical Model and Experimental Results», AIChE Symposium Series, 84, No. 261, 139.
4) Bhattacharyya, D., Barranger, T., Jevtitch, M., and Greenleaf, S., (1987): «Separation of Dilute Hazardous Organics by Low Pressure Composite Membranes», EPA Report, EPA/600/87/053.
5) Bodalo-Santoyo, A., J.L. Gomez-Carrasco, E. Gomez-Gomez, F.Maximo-Martin and A.M. Hidalgo-Montesinos,(2003):,”Application of reverse osmosis membrane to reduce pollutants present in industrial waste water , “Desalination, 155: 101-108.
6) Bodalo-Santoyo, A., J.L. Gomez-Carrasco, E. Gomez-Gomez, M.F. Maximo-Martin and A.M. Hidalgo-Montesinos,(2004):”Spiral wound membrane reverse osmosis and the treatment of industrial effluents”, Desalination, 160: 151- 158.
7) Chian, E., Bruce, W., and Fang, H., (1975): «Removal of Pesticides by Reverse Osmosis», Environmental Science and Technology, 9, 364.
8) Couallier E.M., Ruiz B.S., Lameloise M.L. and Decloux M., (2006):,”Usefulness of reverse osmosis in the treatment of condensates arising from the concentration of distillery vinasses”,Desalination, 196, 306-317.
9) G. Srinivasan,,S. Sundaramoorthy and D.V.R. Murthy (2010):,”Spiral Wound Reverse Osmosis Membranes for the Recovery of Phenol Compounds-Experimental and Parameter Estimation Studies”, American J. of Engineering and Applied Sciences 3 (1): 31-36
10) Koyama, K., Nishi, T., Hashida, I., and Nishimura, M.,(1982):, «The Rejection of Polar Organic Solutes in Aqueous Solution by an Interpolymer Anionic Composite Reverse Osmosis Membrane», Journal of Applied Polymer Science, 27, 28-45.
11) Krishnan S., Kampman, D., Kumar S. and S. Nagar, Groundwater and well water quality in alluvial aquifer of central Gujarat, in Proceedings of IWMI-Tata Water Policy Programme Annual Partner’s Meet, Anand, Gujarat,2005
12) Kurihara, M., Harumiya, N., Kanamaru, N., Tonomura, T., and Nakasatomi, M.(1981):”,Development of the PEC-1000 Composite Membrane for Single-Stage Seawater Desalination and the Concentration of Dilute Aqueous Solutions Containing Valuable Materials, “Desalination, 38: 449.
13) Mane J.D., Modi S., Nagawade S., Phadnis S.P. and Bhandari V.M., (2006): ”,Treatment of spentwash using modified bagasse and colour removal studies,” Bioresource Technology, 97, 1752-1755.
14) Mohamed, B., Saida ,B. and Kensa Bensadok (2006): Groundwater treatment by reverse osmosis, Desalination, 206: 100–106.
15) Moresi, M., B. Ceccantoni and S. Lo Presti, (2002):,”Modeling of ammonium fumarate recovery from model solutions by nanofiltration and reverse osmosis“, J. Membr. Sci., 209: 405- 420.
Membr. Sci., 209: 405- 420.
16) Murthy,G.V.P, and Choudhari,L.B, (2009):, ”Treatment Of Distillery Spent Wash By Combined Uf And Ro Processes“,Global NEST Journal, Vol 11, 2:235-240.
17) Nataraj S.K., Hosamani K.M. and Aminabhavi T.M., (2006): Distillery wastewater treatment by the membrane-based nanofiltration and reverse osmosis processes, Water Research, 40:2349- 2356.
18) Osman A.Hamed, Ata M.Hassan, Khalid Al-Shail and Mohammed A.Farooque (2005):, “Performance Analysis Of A Trihybrid Nf/Ro/MsfDesalination Plant“,International Desalination Association (IDA) World Congress Conference held at Singapore in 2005. Osmosis , Separation Science and Technology, 22: 745.
19) Pozderivic, A., T. Moslavac and A. Pichler,(2006):,”Concentration of aqueous solutions of organic components by reverse osmosis II. Influence of transmembrane pressure and membrane type on concentration of different alcohol solutions by reverse osmosis“, J. Food Eng. , 77: 810-817.
, 77: 810-817.
20) Pusch, W., Yu, Y., and Zheng, L., (1989): «Solute- Solute and Solute-Membrane Interactions in Hyperfiltration of Binary and Ternary Aqueous Organic Feed Solutions», Desalination, 75, 3.
21) Ramana S., Biswas A.K. and Singh A.B., (2002):,”Effect of distillery effluents on some physiological aspects in maize“, Bioresource Technology, 84, 295-297.
22) S. Lee, M. Elimelech, C.Booa, S. Honga, (2010):,” Comparison of fouling behavior in forward osmosis (FO) and reverse osmosis (RO)”, Journal of Membrane Science,365, 34–39
23) Schutte, F.C.,(2003):,”The rejection of specific organic compounds by reverse osmosis membranes“, Desalination, 158: 285-294.
24) Senthilmurugan, S. and S.K. Gupta,(2006):,”Separation of inorganic and organic compounds by using a radial flow hollow fiber reverse module”, Desalination, 196: 221-236.
25) Xu, P., J.E. Drewes, C. Bellona, G. Amy and T.U. Kim et al.,(2005):, ”Rejection of Emerging Organic micro pollutants in nanofiltration- reverse osmosis membrane applications”, Water Environ. Res., 77: 40-48.
26) Zhang S., Yang F., Liu Y., Zhang X., Yamada Y. and Furukawa K., (2006):. Performance of a metallic membrane bioreactor treating simulated distillery wastewater at temperatures of 30 to 45 ºC, Desalination, 194, 146-155.
A Short Review on Process and Applications of Reverse Osmosis
Garud R. M., Kore S. V., Kore V. S., Kulkarni G. S.
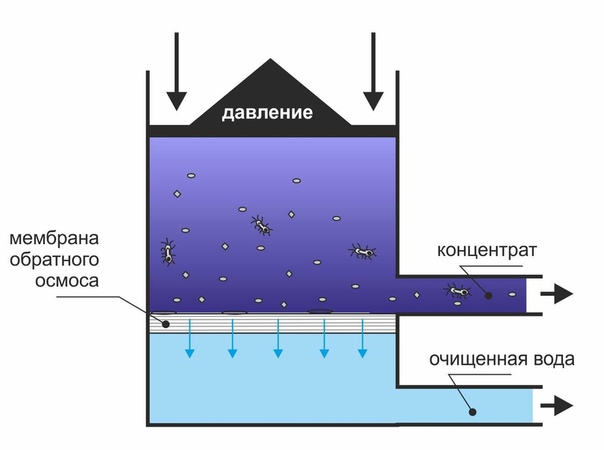
Принцип обратного осмосаПринцип обратного осмоса, в чем заключается и как используется.
Принцип обратного осмоса
Осмос – это процесс односторонней диффузии через полупроницаемую мембрану молекул растворителя в сторону бо́льшей концентрации растворённого вещества из объёма с меньшей концентрацией растворенного вещества. Проще говоря — это природное явление, заключающееся в стремлении воды понизить концентрацию любого солевого раствора, то есть его разбавить. Осмос играет важную роль в обмене веществ всех существующих на земле живых организмов, а также в экологии водоемов.Метод обратного осмоса первоначально был предложен для опреснения морской воды. Ведь если в природе есть силы, заставляющие воду протискиваться через особого строения мембрану ради того, чтобы понизить концентрацию солей на другой её стороне, так почему бы не приложить еще большую силу и не заставить процесс пойти вспять — из высококонцентрированного раствора, каковым является морская вода, в емкость с водой обессоленной? Чем выше концентрация солевого раствора, тем с большей силой стремится его разбавить вода. Эта сила и есть осмотическое давление, которое необходимо преодолеть и добавить немного «сверху» для того, чтобы процесс пошел в обратную сторону.
Нынче принцип обратного осмоса широко используется во многих областях человеческой деятельности, является составной частью высокопрофессиональной очистки воды. Под специально созданным давлением через полупроницаемую тонкопленочную мембрану (синтетический аналог мембраны живой клетки) просачивается собственно вода (Н2О) и растворенные в ней низкомолекулярные газы, такие как кислород, а все примеси остаются снаружи и смываются в дренаж. По эффективности очистки мембранные системы не имеют себе равных: практически она достигает 97-99,9% по разным видам загрязнений. В результате методом обратного осмоса получается глубоко очищенная вода, содержащая растворенный кислород, чем она и отличается от воды, полученной методом дистилляции — там кислорода нет. Из-за наличия растворенного углекислого газа pH очищенной воды ближе к нижней границе нормы, определяемой СанПиН.
Для контроля работы системы обратного осмоса применяется прибор TDS-метр. При погружении в воду его электроды создают постоянное электрическое поле, сила тока в котором напрямую зависит от количества растворенных в воде соединений. Прибор измеряет электропроводность и автоматически пересчитывает её в единицы минерализации (ppm). Из разницы показаний для исходной и прошедшей через обратноосмотическую мембрану воды делается вывод о работоспособности мембраны.
% снижения минерализации = (TDS входной воды-TDS воды на выходе) х 100 / TDS входной воды
Надо заметить, что определять таким методом качество очистки воды обычными сорбционными водоочистителями совершенно бессмысленно — они не обессаливают воду и показания TDS-метра не только не будут различаться на порядки, но и даже наоборот — устранение из воды множества загрязнений электропроводность обычно увеличивает.
Устройство и работа бытовых систем обратного осмоса
Обратноосмотическая мембрана — основной фильтрующий элемент как промышленных так и бытовых обратноосмотических фильтров. Но на мембране можно очищать только воду, прошедшую предварительную комплексную очистку. Иначе мембраны быстро выходят из строя и их использование будет слишком дорогим. Удаление песка, ржавчины и прочих нерастворимых примесей производится механическим картриджем с ячейками до 5 микрон. Затем устанавливается картридж на основе гранулированного кокосового угля. Он сорбирует растворенные в воде органические соединения, часть соединений железа, алюминия, тяжелых и радиоактивных металлов, свободный хлор (если на фильтр подается вода муниципального водопровода) некоторые микроорганизмы. На последней стадии предварительной очистки для мембран обычно ставится 1-микронный картридж механической очистки, защищающий их от мельчайшей угольной пыли и примесей, проскочивших через первые два картриджа.
При хорошей предочистке и своевременной смене картриджей, бытовая обратноосмотическая мембрана может прослужить до 3-х лет. Плохо влияют на срок службы мембраны высокая жесткость воды и высокое содержание железа. Правда, в некоторых случаях менять мембраны экономически более выгодно, чем обеспечить хорошую предварительную очистку, особенно по жесткости и железу. Использование специальных умягчающих и обезжелезивающих картриджей в системе предварительной очистки в таких случаях не имеет смысла, так как 70-85% воды, прошедшей эту очистку, все равно сливается в дренаж, выполняя функцию промывки мембраны и ресурса специализированного десятидюймового картриджа хватит лишь на очень короткий срок.
Работа системы обратного осмоса очень сильно зависит от исходного давления воды. Чем выше давление, тем выше производительность мембраны (в пределах заданной изготовителем). В бытовых обратноосмотических фильтрах скорость просачивания воды через мембрану невелика, а посему домашние установки обратного осмоса обычно укомплектовываются накопительными баками для очищенной воды (пермеата). Вода накапливается во внутреннем эластичном силиконовом мешке, а для подачи в кран используется давление либо воздушной либо водяной прослойки между силиконовым мешком и внешними стенками бака. На пути из бака в кран устанавливается картридж из прессованного активированного угля в целях устранения прошедших через мембрану нежелательных газов.
Отбор из накопительного бака некоторого количества воды запускает процесс фильтрации, наполнение бака — отключает. Процентное соотношение пермеат/концентрат тем выше, чем больше воды слито из бака.
Не прошедшая сквозь мембрану вода уходит в дренаж, смывая с мембраны отфильтрованные соли. Она называется концентрат. Специальный резиновый ободок на бытовой обратноосмотической мембране служит для разделения потоков исходной воды и концентрата. Выход концентрата оснащен ограничителем потока дренажа (либо встроенным в корпус мембраны, либо в виде отдельного устройства) для создания подпора воды.
В том случае, когда давления в водопроводной сети недостаточно для стабильной работы системы её можно доукомплектовать повышающим насосом. При этом на входе насоса необходимо обеспечить отсутствие механических примесей.
Что такое обратный осмос и для чего он нужен
Проблемы низкого качества и нестабильного состава воды, которая течет из крана, актуальны для многих городов России. По мнению экспертов в сфере водоснабжения, главные причины такого явления кроются в отсутствии контроля санитарных зон вокруг водозаборов, недостаточной оснащенности распределительных узлов и изношенности водопроводных сетей. Эффективным способом решения этой проблемы на уровне дома или собственной квартиры считается установка мембранного фильтра, который действует по принципу обратного осмоса (ОО). Ниже мы рассмотрим базовые элементы технологии, оборудование для систем бытовой и промышленной водоподготовки.
Обратный осмос: что это такое
Обратный осмос — это метод очистки воды, при котором раствор проходит под давлением через специальную синтетическую мембрану, где задерживаются до 98% минеральных солей и примесей. Впервые о процессе обратного осмоса заговорили еще в 50-х годах 20 века. Сегодня обратный осмос считается наиболее эффективным способом в области водоподготовки. Пользуется спросом, как у промышленных предприятий, так и в частных домах. Пермеат обратного осмоса это очищенная вода, которая подается на технические и питьевые нужды.
Что такое осмос и обратный осмос: в чем различия
Явление осмоса (прямой осмос) лежит в основе обменных процессов всех живых организмов на клеточном уровне. Благодаря ему «работают» водно-солевой обмен, получение питательных веществ, вывод продуктов жизнедеятельности. Для протекания процесса нужны раствор, растворитель и разделяющая их полупроницаемая мембрана, которая является барьером для растворенного вещества.
Прямой осмос — это баромембранный массообменный процесс. Его можно описать следующим образом: со стороны растворителя возникает осмотическое давление, которое заставляет его молекулы переходить на сторону раствора и разбавлять его. Увеличение объема раствора сопровождается ростом гидростатического давления. Процесс прекращается, когда статическое и осмотическое давления приходят в равновесие.
Важно! В растительных и животных организмах роль полупроницаемой перегородки играет стенка клетки. Искусственные мембраны изготавливаются из органической синтетики.
Если приложить давление со стороны раствора, процесс пойдет в другую сторону. Это и есть обратный осмос. В процессе обратного осмоса по одну сторону мембраны повышается концентрация раствора, а по другую — увеличивается объем растворителя.
Что такое мембрана обратного осмоса
Для фильтров обратного осмоса используют полупроницаемые мембраны. Мембрана обратного осмоса состоит из:
- селективного слоя, который является барьером для примесей;
- армирующего слоя, задающего прочностные показатели мембраны.
В картридже фильтра обратного осмоса мембрана свернута в рулон. Такая конструкция позволяет получить большую площадь активной поверхности и поместить ее в компактный корпус стандартного типоразмера.
Мембрана для обратного осмоса — это главный элемент в системе очистки. Для изготовления мембран подходят следующие материалы:
- Ацетат целлюлозы. Недорогие и простые в изготовлении мембраны из этого материала появились в 1950-х годах. Они отлично справляются с очисткой воды от солей с большой молекулярной массой, но «пропускают» ряд низкомолекулярных соединений. Кроме того, они работают в ограниченном диапазоне pH и подвержены биоразложению. В настоящее время ацетат целлюлозы вытеснен более совершенными материалами.
- Армированный полиамид. Материал работает в широком диапазоне pH и не является питательной средой для микроорганизмов. Прочные полиамидные мембраны выдерживают высокие рабочие давления, имеют хорошую селективность к NaCl и органике. Главный недостаток — низкая устойчивость к окислителям. Вода с повышенным содержанием хлора быстро выводит из строя полиамидные мембраны.
- Тонкопленочные композиты. Мембраны из этого материала — самые совершенные на сегодняшний день. Пленки из композита имеют высокую селективность ко всем известным примесям.
Для чего нужны фильтры с системой обратного осмоса
Системы обратного осмоса — это установки, которые хорошо справляются с удалением растворенных минеральных солей. Очистка воды обратным осмосом — это удаление неорганических соединений из воды от 90 до 98 %.
Мембраны хорошо отфильтровывают органические вещества, молекулы которых значительно крупнее, чем у минеральных солей. Соединения с молекулярной массой выше 150 Da удаляются из воды на 100 %. Вероятность проникновения бактерий и вирусов через фильтр практически нулевая. Исключение составляют картриджи с механическими повреждениями мембраны. Очищенная вода, полученная на нормально работающей установке, не требует кипячения и дозирования дезинфицирующих веществ.
Но что очищает обратный осмос? Все ли вещества задерживаются на мембранах? Обратноосмотические мембраны свободно пропускают растворенные двухатомные газы: кислород, азот, водород.
Очистке на ОО можно подвергать воду с общей минерализацией 3 — 20 г/л с мутностью до 5 ЕМФ и перманганатной окисляемостью до 3 мгО2/л. Среди требований большинства производителей мембран к исходной воде можно выделить также отсутствие сильных окислителей (свободного хлора, озона) и двухвалентного железа.
В чем суть обратного осмоса
Обратный осмос воды — это процесс, который дает на выходе чистую питьевую и техническую воду. Установки обратного осмоса применяются на следующих объектах:
- ГЭС, ТЭЦ, АЭС и других предприятиях энергетики;
- ЖКХ, для водоснабжения объектов первой категории;
- научные и исследовательские лаборатории, в том числе оборонного комплекса;
- индивидуальное водоснабжение.
Для чего нужна установка обратного осмоса
Основные направления использования установок обратного осмоса — очистка воды с целью снижения общей минерализации, опреснение солоноватых вод. Фильтр обратного осмоса — это одна из стадий предподготовки при получении ультра очищенной воды для электронной промышленности, медицины, теплоэнергетики.
Еще одно направление использования обратного осмоса — получение концентратов — широко используется в пищевой промышленности. Сгущенное молоко и концентрированные соки получают путем обратного осмоса.
Промышленный обратный осмос: что это такое
Коммерческие и промышленные установки обратного осмоса представляют собой высокопроизводительные системы очистки воды с полуавтоматическим или полностью автоматизированным управлением. В их состав входит несколько модулей, отвечающих за предварительную подготовку и мембранную очистку.
Типовая установка промышленного обратного осмоса для получения технической воды состоит из следующих элементов:
- Фильтр грубой очистки. Сетка с определенным размером ячейки задерживает нерастворимые частицы.
- Колонна обезжелезивания. В ней двухвалентное железо окисляется до трехвалентного и удаляется в виде нерастворимого осадка.
- Сорбционный фильтр. Активный сорбент поглощает свободный хлор.
- Мембрана обратного осмоса. Удаляет растворенные соли и другие загрязнения. Одно из преимуществ промышленных установок обратного осмоса — масштабируемость. Для увеличения производительности в нее можно добавлять необходимое количество фильтрующих элементов.
Обратный осмос: как это устроено
Для протекания обратного осмоса нужно высокое рабочее давление, которое создается высоконапорным насосом. Системы комплектуются датчиками, манометрами, автоматическими сбросными клапанами, трубной обвязкой. Для контроля качества очищенной воды устанавливают TDS-метр.
Работа установки состоит из двух стадий:
- Очистка воды.
- Промывка мембраны.
Управление выполняется микроконтроллером. Поскольку исходная вода различается по составу, комплектация и наладка системы выполняется индивидуально. Могут потребоваться дополнительные стадии предподготовки.
Важно! При хорошем качестве исходной воды удается отказаться от некоторых стадий предварительной фильтрации, упростить и удешевить установку.
Бытовой обратный осмос для воды: для чего он нужен
На рынке оборудования представлен широкий выбор модульных систем обратного осмоса для частных домов и коттеджей, которые обычно размещают в отдельном помещении. Также есть моноблочные модели для квартир с централизованным водоснабжением. От промышленных обратноосмотических систем их отличает два параметра: производительность и расход воды. Но что такое обратный осмос в бытовых фильтрах?
Бытовая система с обратным осмосом — это компактное устройство, которое работает при сравнительно низких давлениях (до 3 атмосфер). Чаще всего в них нет повысительного насоса, а фильтрация происходит за счет напора в водопроводе. Такие установки производят несколько литров очищенной воды в сутки, что вполне достаточно для частного потребителя. Из-за низкого рабочего давления бытовая мембрана требует промывки чаще, чем промышленная.
В бытовых установках после обратного осмоса устанавливают минерализатор — устройство постобработки, которое обогащает воду полезными для человека минералами в нужных концентрациях. Такая вода предназначена исключительно для питья. На приготовление пищи или горячих напитков минерализация не влияет вообще (или влияет отрицательно).
Важно! Ресурс работы бытовых и промышленных мембран обратного осмоса большинства производителей составляет 1 год. Картриджи предварительной очистки меняют раз в полгода.
Почему обратноосмотические фильтры пользуются спросом
У систем обратного осмоса есть много преимуществ:
- Высокое качество воды при низких энергозатратах.
- Неограниченная производительность и сравнительно небольшие габариты.
- Невысокие эксплуатационные расходы.
- Концентрат не требует утилизации и сбрасывается в канализацию.
Компания Diasel занимается продажей промышленных и бытовых систем обратного осмоса. Наши специалисты предложат готовую модификацию или поберут комплект оборудования для частных заказчиков и предприятий. Мы найдем решение по результатам анализа исходной воды и требуемой производительности. Оформить заявку можно через «Обратную связь» или по телефону 8-499-391-39-59.
Осмос: определение, процесс, примеры | Sciencing
Большинство людей знают, что растениям нужна вода, чтобы оставаться в живых, но выяснить, как часто их поливать, может быть непросто как для ботаников, так и для энтузиастов растений. Один простой трюк — сделать отметку в календаре, когда вы поливаете растение, а затем подождать, пока оно не начнет увядать, чтобы рассчитать, сколько времени нужно ждать между поливами. Идеальное время — незадолго до того, как растение увянет.
Всем клеткам необходимо перемещать молекулы внутрь и из клетки.Некоторые механизмы для достижения этого требуют, чтобы клетка использовала энергию, например, установка насосов в клеточной мембране для транспортировки молекул.
Диффузия — это способ бесплатно перемещать некоторые молекулы через мембрану — из областей с более высокой концентрацией растворенных веществ в области с более низкой концентрацией — без необходимости тратить ценную энергию на клетку. Осмос очень похож на диффузию, но вместо перемещения молекул или растворенного вещества он перемещает растворитель, которым является чистая вода.
Процесс осмоса
Полупроницаемые мембраны, подобные тем, которые обнаруживаются в клетках животных и растений, отделяют внутреннюю часть клетки от того, что находится вне клетки.Процесс осмоса перемещает молекулы воды через полупроницаемую мембрану , когда существует такой градиент концентрации, что на каждой стороне биологической мембраны имеются разные концентрации растворенного вещества.
Осмотическое давление просто перемещает молекулы воды через мембрану до тех пор, пока растворенное вещество (молекула, растворенная в воде) не достигнет равновесия. В этот момент количество растворенного вещества и растворителя (воды) одинаково на каждой стороне мембраны.
Например, рассмотрим раствор соленой воды, в котором соль растворена в воде через мембрану. Если на одной стороне мембраны более высокая концентрация соли, вода перемещается от менее соленой стороны через мембрану к более соленой стороне, пока обе стороны мембраны не станут одинаково солеными.
Три типа примеров осмоса
Процесс осмоса может заставлять клетки сжиматься или расширяться (или оставаться неизменными) с движением молекул воды.Осмос влияет на клетки по-разному в зависимости от типа рассматриваемого раствора.
В случае гипертонического раствора растворенных веществ вне клетки больше, чем внутри клетки. Чтобы уравновесить это, молекулы воды покидают клетку, перемещаясь в сторону мембраны с более высокой концентрацией растворенного вещества. Эта потеря воды вызывает усадку клетки.
Если раствор представляет собой гипотонический раствор , то внутри клетки больше растворенного вещества, чем вне клетки.Чтобы найти равновесие, молекулы воды перемещаются в ячейку, заставляя ячейку расширяться по мере увеличения объема воды внутри ячейки.
Изотонический раствор имеет одинаковое количество растворенного вещества на обеих сторонах клеточной мембраны, поэтому эта клетка уже находится в равновесии. Он останется стабильным, не сжимается и не набухает.
Как осмос влияет на клетки
Хорошей моделью для понимания того, как процесс осмоса влияет на клетки человека, является эритроцит. Организм усердно работает, чтобы поддерживать изотонических условий , чтобы ваши эритроциты оставались в равновесии, не сокращались и не набухали.
В условиях сильного гипертонуса красные кровяные тельца сокращаются, что может убить красные кровяные клетки. Условия с высокой гипотонией ничем не лучше, поскольку эритроциты могут набухать до тех пор, пока не лопнут, что называется лизисом .
В растительной клетке, которая имеет жесткую клеточную стенку за пределами клеточной мембраны, осмос будет втягивать воду в клетку только до определенной точки. Растение хранит эту воду в своей центральной вакуоли. Внутреннее давление в установке, называемое тургорным давлением , предотвращает попадание слишком большого количества воды в ячейку для хранения в вакуоли.
Помните то растение, которое вам нужно было полить? Без достаточного полива вянет, потому что растение теряет тургорное давление.
Осмотический процесс — обзор
ГРАДИЕНТЫ СОЛИЧНОСТИ
Не вдаваясь в подробности термодинамических свойств растворов, мы просто напомним, что любое обратимое смешивание двух растворов разной концентрации при постоянной температуре высвобождает определенное количество свободной энергии, которая может быть доступным для дальнейшего преобразования в полезную энергию.
Принимая во внимание осмотическую концентрацию морской воды и учитывая, что океаны представляют собой квазибесконечный объем постоянной концентрации, расчеты показывают, что смешивание 1 м3 / с пресной воды с морской водой приведет к высвобождению энергии в 2,24 мегаватт.
В целом, эквивалент 30,10 6 МВт будет производиться во всем мире и рассеиваться ежегодно, из которых около 8 процентов будут более доступны в устьях различных рек мира. В качестве примера, поток реки Конго, который составляет порядка 57000 м 3 / с, теоретически может дать около 128000 мегаватт.Если бы только одна десятая потока использовалась с общей эффективностью 25 процентов, это все равно означало бы количество мощности засоления в 3200 МВт, которое можно было бы использовать.
Использование концентрированных рассольных тел, таких как Мертвое море, Великое соленое озеро и т. Д., В качестве приемников, увеличило бы потенциальную энергию примерно в 20 раз из-за значительно более высокого осмотического давления — 500 атмосфер против 25 атмосфер ( атм).
Действительно, если смешать пресную и соленую воду, их физико-химические потенциалы быстро достигнут равновесия без какой-либо практической возможности уловить значительное количество выделяющейся энергии.Поэтому было предложено несколько методов для преобразования этой энергии засоления в пригодную для использования механическую или электрическую форму:
- —
методы, использующие явление выравнивания химических потенциалов в осмотическом процессе;
- —
методы, использующие электрохимические свойства растворов различной концентрации (солености) при разделении анионной и катионообменной мембранами;
- —
«механохимические» методы, основанные на альтернативных деформациях (растяжении и сжатии) определенного класса полимеров при погружении на циклической основе в растворы с различным химическим потенциалом или соленостью; и способы, основанные на разнице давлений пара, которая существует между двумя растворами разной концентрации при одинаковой температуре, или на использовании небольшого количества тепла, выделяемого при необратимом смешивании пресной воды и соленой воды.
Из этих основных концепций первые два до сих пор привлекали наибольшее внимание исследователей и все еще являются предметом рассмотрения в ряде стран, в основном в Израиле, Швеции и США.
Среди различных возможностей, предлагаемых осмотическим процессом (Norman; Wick and Isaacs), предложение Леба из Университета Бен-Гуриона в Негеве в Беэр-Шеве, Израиль (Loeb; Loeb, Van Hessen and Шареф; Леб и Блох), в котором увеличенный объем воды при заданном давлении генерируется и преобразуется в электричество через обычную систему турбины / генератора переменного тока, представляет интерес для дальнейших исследований.
Когда пресная вода отделена от соленой с помощью полупроницаемой мембраны (проницаемой только для чистой воды), пресная вода будет проникать в сторону соленой воды до тех пор, пока концентрации не выровняются. Однако это проникновение можно предотвратить и сохранить исходное равновесие, если к стороне соленой воды приложить достаточное гидравлическое давление, то есть осмотическое давление, обычно обозначаемое p. Когда гидравлическое давление P прикладывается с P <π, но P> P атм (осмос), создаются условия осмоса с запаздыванием под давлением (PRO).
Практически подходящее расположение мембран (пермеатор PRO) подвергается с одной стороны сильному потоку морской воды или концентрированного рассола под давлением выше атмосферного. С другой стороны течет меньшее количество пресной воды атмосферного давления. Часть пресной воды будет протекать через мембрану из-за явления осмоса и приобретет с другой стороны такое же давление, как морская вода или рассол. Этот увеличенный объем (морская вода или рассол плюс определенное количество пресной воды) затем будет турбонаддуван и преобразован в электрическую энергию.Конечный результат, с учетом потока сверхпроникшей пресной воды, не только покроет затраты на энергию морской воды или повышения давления рассола, но также позволит получить положительное чистое производство сборных шин.
Для таких установок мембраны должны быть как можно более тонкими и прочными, чтобы два раствора, демонстрирующие большие перепады гидравлического давления, находились очень близко друг к другу, чтобы максимизировать осмотический эффект. Мембраны также должны выдерживать длительный контакт с морской водой или рассолом, быть устойчивыми к бактериям с одной стороны и располагаться в конфигурации, которая ограничивает, если не устраняет, риск забивания биообрастанием или взвешенными частицами с другой стороны.
Мембраны из ацетата целлюлозы и ароматического полиамид-гидразида для обратного осмоса, используемые при опреснении воды, коммерчески доступны в различных формах, то есть в виде листов различной конфигурации и полых тонких волокон, которые могут быть собраны в пакеты с высокой плотностью. Мембраны для извлечения энергии засоления все еще требуют серьезных исследований и разработок, чтобы быть технически и экономически приемлемыми, и концепция и производство таких мембран должны стать приоритетной задачей в ближайшие годы.
Предварительные экономические расчеты ясно показывают необходимость достижения прорыва в мембранной технологии и повышения ее стоимости на один или два порядка, если концепция должна стать достаточно привлекательной для проведения значительных промышленных исследований и разработок.
Как упоминалось ранее, другим возможным методом извлечения энергии из градиентов солености является использование ионообменных мембран и непосредственная выработка электричества через так называемую диалитическую батарею.Когда два контейнера с пресной и соленой водой разделены, например, катионной мембраной (проницаемой для катионов), с соответствующими электродами (Ag / AgCl), закрепленными на каждом конце контейнеров, между двумя контейнерами будет создаваться разность электрических потенциалов. электроды и, возможно, используются в практических целях (Вайнштейн и Лейтц).
Шведская группа недавно провела предварительную оценку возможностей концепции диализных батарей для выработки электроэнергии из градиентов солености в Швеции.Специальное расположение мембран обеспечивает перекрестный поток пресной воды со скоростью 390 м 3 / с и соленой воды с соленостью 0,6 и 30 ° / с с соленостью 1 500 м 3 / с соответственно. Общая схема будет представлять собой плавучую конструкцию размером 1000 × 250 м, состоящую из аккумуляторных модулей мощностью 20 кВт, и будет иметь выходную мощность 200 мегаватт.
Предварительная оценка затрат показывает, что стоимость киловатт-часа составляет 0,032 доллара США с погрешностью ± 20 процентов при общих инвестициях в размере 133 миллионов долларов или 620 долларов США / кВт, 68 процентов от этой общей суммы составляют аккумуляторные модули.
Та же шведская группа также исследовала систему мощностью 100 МВт, используя «механохимические» свойства определенных полимеров при погружении в растворы различной солености, как упоминалось выше. Предусмотрены два типа полимеров с коротким (3 секунды) и длинным (30 секунд) циклами растяжения / сжатия. В первом случае полимер, захваченный в цилиндре, соединенном с коленчатым валом генератора, способен производить 0,5 мас. / Г полимера, то есть 1,25 кВт на цилиндр. Во втором случае будет произведена только одна десятая от предыдущего показателя при том же общем потоке в 390 кубометров в секунду.Для производства 100 мегаватт потребуется около 80 000 цилиндров в первом случае и 800 000 — во втором.
Расчетная стоимость произведенного киловатт-часа для полимеров с коротким и длинным циклом составляет 0,019 доллара и 0,055 доллара при общих инвестиционных затратах на киловатт в 420 долларов и 1470 долларов, соответственно.
Несмотря на довольно интересный и обнадеживающий подход Леба и его сотрудников, а также шведской команды, все еще существует значительная потребность как в фундаментальных исследованиях, так и в промышленных разработках.Более конкретно, целый ряд новых типов мембран (для PRO и диалитических систем) еще предстоит разработать и / или экономично произвести с более высокими характеристиками механической и химической стойкости с особым упором на стойкость к концентрированному рассолу в течение длительных периодов времени. Кроме того, проблема защиты мембран от микроорганизмов, а также бактерий, принимая во внимание большие скорости потока, является критической и требует важных и постоянных исследовательских усилий.
Хотя важно признать потенциал и экологические преимущества градиентов солености как возможного альтернативного источника энергии, сомнительно, что эта концепция может быть использована в промышленном масштабе в ближайшем будущем, если это произойдет в европейских, американских или развивающихся странах. уровни. Кроме того, следует отметить, что для морских развивающихся стран концепция OTEC, а также технически зрелые приливные системы представляют собой гораздо более привлекательные и разумные предложения по развитию их основных возобновляемых источников энергии.
Что такое осмос?
В течение оставшейся части недели мы будем просить вас оценить различные стратегии обучения, чтобы помочь студентам справиться с осмосом, начиная с использования анимации в биологии, затем практической работы и, наконец, моделирования. Но сначала мы начнем с краткого обзора того, что такое осмос. Вот определение осмоса, которое вы встретите в большинстве учебников: В биологии осмос — это перемещение молекул воды из раствора с высокой концентрацией молекул воды в раствор с более низкой концентрацией молекул воды через частично проницаемую мембрану клетки.Частично проницаемая мембрана (иногда называемая селективно проницаемой мембраной) позволяет только определенным молекулам или ионам пересекать ее. На диаграмме выше более высокая концентрация молекул воды слева от частично проницаемой мембраны делает вероятным, что большое количество молекул воды столкнется с мембраной и пройдет через нее. Более низкая концентрация молекул воды в правой части частично проницаемой мембраны на диаграмме делает вероятным, что меньшее количество молекул воды будет сталкиваться с мембраной и проходить через нее.4,9
34 Отзывы
Это означает, что на этой диаграмме слева направо движется больше молекул воды, чем справа налево, и поэтому общее движение (чистое движение) происходит вправо. Однако важно подчеркнуть для студентов, что молекулы воды движутся в обоих направлениях.Вы часто будете видеть это как движение «вниз по градиенту концентрации», означающее, что вода движется от более высокой концентрации воды (в данном случае разбавленного раствора сахарозы) к более низкой концентрации воды (концентрированный раствор сахарозы). Если растительная клетка окружена раствором, который содержит более высокую концентрацию молекул воды, чем раствор внутри клетки, вода попадет в клетку посредством осмоса, и растительная клетка станет тургучной (твердой). Давление, которое развивается внутри растительной клетки, когда она становится набухшей, называется тургорным давлением.Плотные клетки растений помогают стволу оставаться в вертикальном положении. Если растительная клетка окружена раствором, который содержит более низкую концентрацию молекул воды, чем раствор внутри растительной клетки, вода покинет клетку за счет осмоса, и растительная клетка станет вялой (мягкой). Если клетки в стебле растения становятся вялыми, тургорное давление внутри них снижается, и стебель увядает. Если растительная клетка окружена раствором, который содержит ту же концентрацию молекул воды, что и раствор внутри растительной клетки, общий чистый поток воды отсутствует.Движение молекул воды в клетку и из клетки через частично проницаемую мембрану уравновешивается.Транспирация поддерживает движение воды
У растений вода попадает в клетки корня посредством осмоса и перемещается по трубкам, называемым ксилемными сосудами, для транспортировки к листьям. Молекулы воды внутри клеток ксилемы сильно притягиваются друг к другу из-за водородных связей (это называется когезией). Когда вода испаряется из листьев (через крошечные поры, называемые устьицами), из клеток ксилемы корня вытягивается больше воды, чтобы заменить потерянную.Таким образом, непрерывный столб воды поднимается вверх по стеблю в сосудах ксилемы за счет испарения с листьев. Это называется испарением.Найдите и поделитесь
Этот тип диаграмм и объяснений довольно часто встречается в учебниках по биологии, но движение молекул довольно абстрактно, и ученикам может быть трудно представить себе это.
Поищите в Интернете ресурс, который помогает студентам объяснить осмос, и поделитесь приведенной ниже ссылкой с объяснением, почему это полезно.
© Национальный учебный центр STEM
Диффузия и осмос | Протокол
Клеточные мембраны и диффузия
Для того, чтобы функционировать, клетки должны перемещать материалы в свою цитоплазму и из нее через клеточные мембраны.Эти мембраны полупроницаемы, что означает, что одни молекулы могут проходить сквозь них, но не другие. Это движение молекул опосредуется фосфолипидным бислоем и встроенными в него белками, некоторые из которых действуют как транспортные каналы для молекул, которые в противном случае не могли бы проходить через мембрану, таких как ионы и углеводы.
Размер ячейки и отношение площади поверхности к объему
Одна из причин, по которой клетки настолько малы, — это необходимость транспортировать молекулы внутрь клетки и из нее.На клетки накладывается геометрическое ограничение из-за взаимосвязи между площадью поверхности и объемом, которое ограничивает способность вносить достаточное количество питательных веществ для поддержания большего размера клеток. Соотношение между площадью поверхности и объемом (SA: V) уменьшается по мере увеличения размера ячейки из-за различных коэффициентов масштабирования площади поверхности и объема. Это означает, что по мере роста клетки уменьшается площадь мембраны, способная доставлять питательные вещества в больший объем клетки.
Некоторые ионы попадают в клетку путем диффузии, которая представляет собой чистое перемещение частиц из области с высокой концентрацией в область с более низкой концентрацией.Это известно как движение вниз по градиенту концентрации. Распространение чисто направленное; в то время как чистое движение частиц происходит вниз по градиенту концентрации, они постоянно движутся в обоих направлениях из-за случайного движения частиц. Это означает, что частицы в растворах при равновесии все еще движутся, но с постоянной скоростью обмена, поэтому раствор остается равномерно перемешанным. В водной среде, такой как клетка, этот процесс включает растворенные ионы, известные как растворенные вещества, движущиеся через воду, растворитель.Это может происходить в открытой среде, например, при распространении красителя через химический стакан, или через клеточную мембрану, например, при движении ионов через белковый канал.
Осмос и движение воды
Вода перемещается через клеточные мембраны путем диффузии в процессе, известном как осмос. Осмос относится, в частности, к движению воды через полупроницаемую мембрану, при этом растворитель (например, вода) перемещается из области с низкой концентрацией растворенного вещества (растворенного материала) в область с высокой концентрацией растворенного вещества.В этом случае полупроницаемая мембрана не пропускает растворенное вещество. Это можно представить себе как движение воды вниз по собственному градиенту концентрации, и это включает тот же случайный процесс, что и диффузия.
Растворы, разделенные полупроницаемыми мембранами, могут быть описаны как гипертонические, гипотонические или изотонические в зависимости от относительных концентраций растворенных веществ в каждом из них. Гипертонический раствор ( hyper- означает «сверху» по-гречески) имеет более высокую концентрацию растворенных веществ, чем соседний раствор, в то время как гипотонический раствор ( hypo- означает «ниже» по-гречески) имеет более низкую концентрацию растворенных веществ. .В этой ситуации вода будет переходить из гипотонического раствора в гипертонический до тех пор, пока концентрации растворенного вещества не станут равными. Изотонические растворы ( iso- , что по-гречески означает «равный») имеют равные концентрации растворенного вещества и, следовательно, не имеют градиента концентрации 1 .
Осмос и растительная клетка
Способность воды проникать в клетки различается между растительными и животными клетками из-за наличия у растений клеточной стенки. Стенки клетки жесткие и проницаемы только для очень маленьких молекул.Когда вода попадает в клетку, мембрана прижимается к клеточной стенке, создавая гидростатическое или тургорное давление. Это давление ограничивает скорость и количество воды, которая может попасть в ячейку. Вероятность проникновения воды в ячейку называется водным потенциалом, количественно определяемым как потенциал давления плюс потенциал растворенного вещества. Потенциал давления зависит от давления внутри ячейки, а потенциал растворенного вещества зависит от концентрации растворенного вещества в ячейке.
Водный потенциал можно наблюдать в действии в живой растительной клетке, такой как Elodea , водное растение.Под микроскопом можно наблюдать явление, называемое потоком цитоплазмы, или циклозом, при котором цитоплазма и органеллы, такие как хлоропласты, перемещаются по клетке. Этот процесс заметно меняется, когда клетки погружаются в разные растворы. Интересно, что это движение позволяет хлоропластам более эффективно функционировать в фотосинтезе; они входят и выходят из тени, собирая фотоны, когда они снова входят в освещенные области ячеек 3 .
Процесс осмоса необходим для механизма, посредством которого растения получают воду от корней до листьев даже на высоте нескольких десятков футов над уровнем земли.Короче говоря, растения транспортируют сахар и другие растворенные вещества к своим корням, чтобы создать градиент между внутренней и внешней частью корня; вода из почвы затем перемещается к корням путем осмоса. С этого момента процесс, называемый транспирацией, приводит к тому, что вода поднимается вверх по трубкам внутри растения, называемым ксилемой, и испаряет листья. В идеале, как только этот водяной столб установлен, он остается неповрежденным на протяжении всей жизни растения. 4
Это естественное явление было использовано для разработки ценных технологий.Один из примеров — очистка воды. Недавно НАСА начало изучение использования процесса прямого осмоса для очистки и повторного использования сточных вод на борту Международной космической станции, а также для приложений, связанных с Землей. 2 В этом процессе используются полупроницаемые мембраны для удаления примесей из воды, что делает ее безопасной для питья. Эта технология была недавно применена для оказания помощи при сильном наводнении в Западной Кении 5 .
Список литературы
- Сульт, Эллисон. LibreTexts, Химия. 8.4 Осмос и диффузия. [Online], 19 октября 2017 г. https://chem.libretexts.org/LibreTexts/University_of_Kentucky/UK%3A_CHE_103_-_Chemistry_for_Allied_Health_(Soult)/Chapters/Chapter_8%3A_Properties_D%MO_Solutions_Of_Solutions_Offy_Solutions
- Левин, Ховард. Сумка для прямого осмоса НАСА. Космический центр Кеннеди НАСА, мыс Канаверал, Флорида, США. [Online] 11 июля 2018 г. https://www.nasa.gov/mission_pages/station/research/experiments/846.html.
- Додонова С.О., Булычев А.А. (2011). «Влияние потока цитоплазмы на фотосинтетическую активность хлоропластов в междоузлиях Chara Corallina ». Российский журнал физиологии растений . 59 : 35–41. DOI: 10,1134 / S1021443711050050.
- Осмос и питание растений. Хаммер, Майкл. 2000, Рододендрон, т. 40.
- Инновации в технологии гидратации. Гуманитарная фильтрация воды прямым осмосом.[Онлайн] [Цитировано: 21 августа 2018 г.] http://www.htiwater.com/divisions/humanitar/lead_story.html.
Распространение и осмос — разница и сравнение
Осмос является результатом диффузии через полупроницаемую мембрану. Если два раствора разной концентрации разделены полупроницаемой мембраной, тогда растворитель будет диффундировать через мембрану от менее концентрированного раствора к более концентрированному.Этот процесс называется осмосом . На клеточном уровне оба процесса являются типами пассивного транспорта.
Полупроницаемые мембраны представляют собой очень тонкие слои материала, через которые проходят небольшие молекулы, такие как кислород, вода, углекислый газ, аммиак, глюкоза, аминокислоты и т. Д. Однако они не пропускают более крупные молекулы, такие как сахароза, белок и т. Д.
Таблица сравнения
| Диффузия | Осмос | |
|---|---|---|
| Что это? | Диффузия — это самопроизвольное перемещение частиц из области с высокой концентрацией в область с низкой концентрацией.(например, ароматизатор чая перемещается из зоны высокой концентрации в зону низкой концентрации в горячей воде.) | Осмос — это спонтанное чистое движение воды через полупроницаемую мембрану из области с низкой концентрацией растворенного вещества в более концентрированный раствор с повышенным градиентом концентрации. Это уравнивает концентрации с обеих сторон мембраны. |
| Процесс | Диффузия в основном происходит в газообразном состоянии или внутри молекул газа и молекул жидкости.(Например, молекулы двух газов находятся в постоянном движении, и если разделяющая их мембрана будет удалена, газы будут смешиваться из-за случайных скоростей.) | Это происходит, когда среда, окружающая клетку, имеет более высокую концентрацию воды, чем клетка. Клетка получает воду вместе с важными молекулами и частицами для роста. Это также происходит, когда вода и частицы перемещаются из одной ячейки в другую. |
| Значение | Для создания энергии; Помогает в обмене газов при дыхании, фотосинтезе и транспирации. | У животных осмос влияет на распределение питательных веществ и выброс продуктов метаболизма. У растений осмос частично отвечает за поглощение почвенной воды и подъем жидкости к листьям растений. |
| Градиент концентрации | Переход от градиента высокой концентрации к градиенту низкой концентрации | Уменьшает градиент концентрации |
| Вода | Не требует воды для движения | Требуется вода для движения |
| Примеры | Духи или освежитель воздуха, где молекулы газа диффундируют в воздух, распространяя аромат. | Движение воды в корневые волосковые клетки. |
Процесс осмоса в сравнении с диффузией
Процесс распространения. Некоторые частицы (красные) растворяются в стакане воды. Первоначально все частицы находятся около одного угла стекла. Когда все частицы беспорядочно перемещаются («рассеиваются») в воде, они в конечном итоге распределяются беспорядочно и равномерно.Диффузия происходит, когда спонтанное чистое движение частиц или молекул распространяет их из области с высокой концентрацией в область с низкой концентрацией через полупроницаемую мембрану.Это просто статистический результат случайного движения. Со временем дифференциальный градиент концентраций между высокой и низкой будет уменьшаться (становиться все более мелким), пока концентрации не выровняются.
Диффузия увеличивает энтропию (случайность), уменьшая свободную энергию Гиббса, и поэтому является ярким примером термодинамики. Диффузия действует в рамках второго закона термодинамики, потому что она демонстрирует тенденцию природы «свертываться», искать состояние с менее концентрированной энергией, о чем свидетельствует возрастающая энтропия.
Осмос — это процесс диффузии воды через полупроницаемую мембрану. Молекулы воды могут свободно проходить через клеточную мембрану в обоих направлениях, внутрь или наружу, и, таким образом, осмос регулирует гидратацию, приток питательных веществ и отток отходов, среди других процессов.
Осмос в растительной клеткеНапример, если среда, окружающая растительную или животную клетку, имеет более высокую концентрацию воды, чем клетка, то клетка будет набирать воду за счет осмоса.Общий результат состоит в том, что вода попадает в клетку, и клетка, вероятно, гидратируется и набухает. Если среда имеет более низкую концентрацию воды, чем клетка, она будет терять воду из-за осмоса, поскольку на этот раз больше воды покидает клетку, чем входит в нее. Следовательно, клетка будет сжиматься. Если концентрация воды в среде точно такая же, тогда ячейка останется того же размера, пока сохраняется баланс концентраций. В любой ситуации растворитель перемещается от менее концентрированного (гипотонического) к более концентрированному (гипертоническому) раствору, что имеет тенденцию уменьшать разницу в концентрации (выравнивание).
Различия в функциях
В то время как осмос влияет на распределение питательных веществ и выброс продуктов метаболизма в организме животных; у растений осмос частично отвечает за поглощение почвенной воды и подъем жидкости к листьям растений.
Диффузия может происходить через клеточную мембрану, и мембрана позволяет небольшим молекулам, таким как вода (H 2 O), кислород (O 2 ), углекислый газ (CO 2 ) и другие, легко проходить через них.Следовательно, в то время как осмос помогает растениям поглощать воду и другие жидкости, диффузия помогает другим молекулам проходить через них и, следовательно, обе облегчают процесс фотосинтеза. Оба процесса помогают растениям вырабатывать энергию и другие важные питательные вещества.
Различные типы осмоса и диффузии
Осмотическое действие различных растворов на клетки кровиОсмос двух типов:
- Обратный осмос : Осмотическое давление определяет, в какой момент разность градиента между высоким и низким содержанием растворенных веществ запускает осмос.При обратном осмосе повышенное объемное или атмосферное давление «выталкивает» более высокие частицы растворенного вещества через мембрану, преодолевая зазор, который может существовать, когда осмотическое давление не позволяет диффузии через мембрану. Этот процесс часто используется для фильтрации воды от примесей, когда их концентрация слишком низка для нормального осмоса, но все же требуется более чистая вода, как при опреснении и фармацевтических операциях.
- Прямой осмос : В отличие от обратного осмоса, который переходит от высоких к низким концентрациям, прямой осмос заставляет частицы с низким содержанием растворенных веществ переходить в раствор с более высоким содержанием — по сути, в противоположность нормальному осмотическому процессу.В то время как обратный осмос «выталкивает» частицы, прямой осмос «втягивает» их внутрь, в результате чего вода становится чище.
Типы диффузии :
- Поверхностная диффузия : Видно после капель порошкообразных веществ на поверхность жидкости.
- Броуновское движение : Случайное движение, наблюдаемое под микроскопом, когда частицы прыгают, скользят и устремляются в жидкости.
- Коллективная диффузия : диффузия большого количества частиц в жидкости, которые остаются неповрежденными или взаимодействуют с другими частицами.
- Осмос : диффузия воды через клеточную мембрану.
- Вытекание : Происходит, когда газ рассеивается через небольшие отверстия.
- Диффузия электронов : Движение электронов, приводящее к возникновению электрического тока.
- Облегченная диффузия : Спонтанный пассивный перенос ионов или молекул через клеточную мембрану (отличается, потому что это происходит вне активной фазы осмоса или внутриклеточной диффузии).
- Диффузия Кнудсена : переменная мера взаимодействия частиц внутри поры мембраны, связанная с размером частицы, длиной и диаметром поры.
- Импульсная диффузия : Распределение количества движения между частицами, в основном в жидкостях, под влиянием вязкости жидкости (более высокая вязкость = более высокая диффузия количества движения).
- Распространение фотонов : движение фотонов внутри материала, а затем их рассеяние, когда они отражаются от разных плотностей внутри.Используется в медицинских тестах в качестве диффузного оптического изображения.
- Обратная диффузия : Аналогично прямому осмосу, с переходом от низкой концентрации к высокой, но относится к разделению частиц, а не только воды.
- Самодиффузия : коэффициент, измеряющий степень диффузии, которую будет иметь тип частицы, когда химический градиент равен нулю (нейтральный или сбалансированный).
Список литературы
Поделитесь этим сравнением:
Если вы дочитали до этого места, подписывайтесь на нас:
«Диффузия и осмос.» Diffen.com. Diffen LLC, nd Web. 18 августа 2021 г. <>
Полное руководство по осмосу
Знаете ли вы, что в зависимости от размера вашего тела от 55% до 78% составляет вода? Осмос — один из наиболее важных биологических процессов в живых организмах, поскольку это метод, позволяющий воде распространяться по клеткам; без воды клетки погибнут. Это справочное руководство по осмосу покажет, насколько важен этот процесс для выживания.
Обзор осмоса
Осмос — это прохождение воды из зоны с низкой концентрацией растворенных веществ через полупроницаемую мембрану в область с высокой концентрацией растворенных веществ для выравнивания концентраций растворенных веществ с обеих сторон.Растворитель — это основное вещество, в котором растворенное вещество растворяется, и в результате получается раствор. Через осмос вода поступает в клетки вашего тела; он играет значительную роль в сохранении жизни. Именно этот процесс помогает растениям получать воду и даже используется при диализе почек.
Факторы, влияющие на скорость осмоса
Температура — Чем выше температура, тем быстрее молекулы воды перемещаются через полупроницаемую мембрану.
Площадь поверхности — Чем больше площадь поверхности, тем больше места для молекул, которые могут легко перемещаться; чем меньше площадь, тем более ограничены движения молекул и тем медленнее движение.
Разница в потенциале воды — Чем выше разница в потенциале воды, тем быстрее осмос; поскольку меньшие молекулы воды находятся в области низкой концентрации, большее количество молекул воды из области более высокой концентрации может проникать быстрее и легче.
Давление — Чем больше давление, тем быстрее будут двигаться молекулы, поскольку они быстрее выталкиваются при низкой концентрации.
Градиент концентрации — На движение осмоса влияет градиент концентрации; чем ниже концентрация растворенного вещества в растворителе, тем быстрее будет происходить осмос в этом растворителе.
Свет и тьма — Они также являются факторами осмоса; поскольку чем ярче свет, тем быстрее происходит осмос.
Осмотическое давление
Осмотическое давление является коллигативным свойством. Другими словами, это зависит от молярной концентрации растворенного вещества, но не от его плотности. Это давление, которое прикладывается к раствору, чтобы предотвратить поток воды внутрь через полупроницаемую мембрану, или, проще говоря, это давление, необходимое для остановки осмоса. Осмотическое давление отображается, когда молекулы воды, которые пытаются пересечь полупроницаемую мембрану, не могут сделать это.
Пример осмотического давления: поместите немного изюма в чашку с водой на несколько часов, обратите внимание, что он набухнет и, если держать дольше, лопнет. Причина в том, что вода продолжает диффундировать в мембранную оболочку изюма; этот приток воды создает внутреннее давление, и по достижении его предела внешняя оболочка изюма лопнет, когда она больше не сможет выдерживать давление.
Осмотический градиент
Осмотический градиент — это разница между двумя концентрированными растворами по обе стороны от полупроницаемой мембраны, которая отличает различный процент от конкретной концентрации частиц, растворенных в растворе. Осмотический градиент действует на растворы, имеющие между собой полупроницаемую мембрану; позволяя воде диффундировать между двумя растворами по направлению к раствору с более высокой концентрацией. В конце концов, вода с более высокой концентрацией будет равномерно рассеиваться в сторону меньшей концентрации.Это создает равновесие, когда вода продолжает течь одинаково в обоих направлениях, в результате чего получается стабилизированный раствор.
Варианты
1. Обратный осмос — это процесс разделения с использованием давления, заставляющего растворитель проходить через полупроницаемую мембрану, которая удерживает растворенное вещество на одной стороне и направляет чистый растворитель на другую сторону. Другими словами, это процесс, при котором осмотическое давление применяется для вытеснения растворителя из области с высокой концентрацией растворенного вещества в область с низкой концентрацией растворенного вещества.
Примеры: Для решения проблемы нехватки воды дождевая вода очищается как питьевая. На крупных предприятиях обратный осмос используется для удаления минералов из котловой воды для повторного использования. Обратный осмос — это метод, используемый при диализе печени. Аппарат для диализа имитирует функцию почек.
2. Прямой осмос использует осмос для непосредственного отделения воды от исходного раствора с нежелательными растворенными веществами. Раствор вытяжка использует исходный раствор для проталкивания воды через полупроницаемую мембрану; в результате чего исходный раствор становится концентрированным, а раствор вытяжного материала становится разбавленным.Раствор draw , который теперь разбавлен, можно использовать с поглощаемым растворенным веществом, таким как глюкоза, или передать во вторичный процесс из растворенного вещества draw .
Примерами прямого осмоса являются опреснение, очистка воды и переработка пищевых продуктов.
Типы решений
Есть три различных типа решений, которые используются для описания движения воды. Первый — это гипертонический раствор. Гипертонический раствор имеет более высокую концентрацию растворенного вещества, чем другие типы растворов.Когда животная клетка помещается в гипертонический раствор, она теряет воду и сжимается. Это называется вялой клеткой. Второй тип раствора называется гипотоническим. Этот раствор имеет низкую концентрацию растворенного вещества по сравнению с другими растворами. Когда животная клетка помещается в такой раствор, клетка впитывает всю воду и раздувается. Конечным типом решения является изотонический раствор. Этот раствор не имеет разницы в концентрации растворенного вещества на полупроницаемой мембране, поэтому нет чистого движения воды через мембрану.
Дополнительные ресурсы
Что такое осмос — важнейший принцип биологии
Осмос — это биофизическое явление, при котором вода (или другой растворитель) перемещается из менее концентрированного раствора в более концентрированный раствор через частично проницаемую мембрану (другими словами, она пропускает одни частицы, блокируя другие).
Растворитель будет поддерживать эту миграцию до тех пор, пока не будет достигнуто равновесие по концентрации.
Таким образом, всякий раз, когда возникает чистая миграция молекул воды из раствора с низкой концентрацией растворенного вещества в раствор с более высокой концентрацией, мы называем это явление осмосом. Это движение также иногда называют «спуском по градиенту концентрации».
Осмотическое давление — это сила, необходимая для предотвращения движения воды через полупроницаемую мембрану.
Термин «осмос», что по-гречески означает «тяга» или «импульс», был впервые введен Дж.А. Нолле, который в 1747 году описал эксперимент, в котором он использовал мочевой пузырь животного, чтобы разделить две камеры с водой и вином. Он заметил, что объем в камере с вином увеличивался, и, если камера была закрыта, давление возрастало.
Как работает осмос
Классический эксперимент по осмосу включает разделение стакана с водой на две половины с полупроницаемой мембраной между ними и добавлением соли с одной из сторон. Вскоре вы заметите, что вода, не содержащая соли, мигрирует со стороны стакана с физиологическим раствором.Это движение воды будет продолжаться до тех пор, пока концентрация соли с обеих сторон не станет одинаковой.
Это та же самая причина, по которой вы никогда не должны класть улитку рядом с солью, так как это может привести к гибели бедняги при добыче воды.
Ключом к осмосу является наличие полупроницаемой мембраны, которая увеличивает вероятность столкновения молекул воды в растворе с низкой концентрацией с мембраной и прохождения сквозь нее, в то время как молекулы воды в концентрированном растворе будут иметь гораздо меньше молекул воды, сталкивающихся с мембрана и прохождение.Это несоответствие означает, что существует большая статистическая вероятность того, что большее количество молекул воды пройдет через мембрану из менее концентрированного раствора. Как только статистическая вероятность прохождения молекул воды через мембрану становится равной, осмос прекращается.
Осмос в природе
Осмос — один из важнейших процессов в жизни. Каждая клетка нашего тела, растения и животные вокруг нас обязаны своим выживанием осмосу.
Возьмем, к примеру, растения. Когда мы их поливаем, мы поливаем им конец стебля и почву.Если клетки растения окружены раствором, который содержит более высокую концентрацию молекул воды, чем раствор внутри клеток, вода будет попадать в листья, плоды и цветы путем осмоса. Во время этого процесса растительная клетка станет твердой.
Однако, если растение окружено раствором с более низкой концентрацией воды, молекулы воды из раствора внутри клеток растения будут вытеснены осмосом, в результате чего растение станет вялым.
Когда мы поливаем растения, мы обычно поливаем конец стебля и почву, в которой они растут.Следовательно, корни растений впитывают воду, а от корней вода перемещается к различным частям растений; будь то листья, плоды или цветы. Каждый корень действует как полупроницаемый барьер, который позволяет молекулам воды переходить от высокой концентрации (почва) к низкой концентрации (корни). У корней есть волосы, которые увеличивают площадь поверхности и, следовательно, потребление воды растениями.
Возможно, более интересный пример находится в наших собственных телах. Когда мы пьем воду, клетки поглощают ее путем осмоса, как корни растений.Клеточная стенка действует как полупроницаемая мембрана, создавая осмотическое давление между внутренней и внешней частью клетки. Кровь — более разбавленный раствор, чем цитоплазма клетки, поэтому вода будет проходить через клеточную стенку. То же самое касается питательных веществ и минералов, которые также переносятся осмосом.
Люди осознали потенциал осмоса с древних времен, используя его для сохранения продуктов. Древние заметили, что добавление соли или сахара удаляет воду из тканей. В то время этот процесс назывался пропиткой из-за того, что растворенные вещества, такие как соль и сахар, притягивали воду из материала, которого они касались.
В чем разница между осмосом и диффузией
Диффузия и осмос являются пассивными транспортными процессами, что означает, что они не требуют затрат энергии для перемещения веществ. Оба процесса необходимы для правильного функционирования биологических процессов, таких как перенос воды или питательных веществ между клетками.
Основное различие между ними состоит в том, что диффузия может происходить в любой смеси, даже если два раствора не разделены полупроницаемой мембраной, тогда как осмос происходит исключительно через полупроницаемую мембрану.
Распространение делает состав воздуха однородным за счет перераспределения химических веществ, таких как кислород в воздухе, до тех пор, пока не будет достигнуто равновесие: другими словами, до тех пор, пока градиент концентрации — разница в концентрации между двумя областями — не будет устранен. Если концентрация вида изначально неоднородна, со временем диффузия вызовет массоперенос в пользу более однородной концентрации.
Итог: Осмос — естественное движение воды в раствор через полупроницаемую мембрану — является центральным во всей биологии.Это пассивный транспортный процесс, похожий на диффузию, но они отличаются друг от друга.